進行肺癌の気道狭窄に対する
化学療法併用PDT(Photodynamic therapy ) の検討
| 宮島 邦治1) 木村 雅一1)、石川 里奈子1)、 米山 礼美1)、瀧沢 延彦1)、 坂田 義詞1)加藤 靖文1)3)、 河野 貴文1)、奥仲 哲弥1)2)、 加藤 治文4) |
1)新座志木中央総合病院 呼吸器外科 2)山王病院 呼吸器センター 3)公立学校共済組合関東中央病院 呼吸器外科 4)新座志木中央総合病院名誉院長、国際医療福祉大学院教授、 東京医科大学名誉教授 |
| Kuniharu Miyajima Masakazu Kimura,Rinako Ishikawa, Remi Yoneyama,Nobuhiko Takizawa, Yoshitsugu Sakata,Yasufumi Kato, Takafumi Kono,Tetsuya Okunaka, Harubumi Kato |
1)Department of Thoracic Surgery, Niizashiki Central General Hospital, 2)Pulmonary Disease Center,Sanno Hospital, 3)Department of Thoracic Surgery, Kanto Central Hospital of the Mutual Aid of Public School Teachers, 4)Honorary President Niizashiki Central General Hospital Professor International University of Health and Welfare Emeritus Professor Tokyo Medical University |
| 要 旨 | 光線力学的治療(PDT)は中心型早期肺癌に対する根治療法として確立さているが、中枢性気道狭窄・閉塞病変を有する進行肺癌に対してPDTを化学療法と併用して施行した報告は少ない。手術困難症例で気道狭窄・閉塞を伴う進行肺癌に対して、化学療法併用PDTにより気道開大できた12例について検討した。【対象】男性8例、女性4例、平均年齢73.3歳(58−80歳)、狭窄部位は、気管分岐部1例、右主気管支2例、右上葉支4例、右中間気管支幹3例、右底幹支1例、左上葉支1例、組織型は、扁平上皮癌 7例、腺癌3例、大細胞神経内分泌癌1例、巨細胞癌1例、病期はIIA期1例、IIB期1例、 IIIA期2例 、IIIB期3例 、IV期5例。【方法】化学療法(プラチナダブレット又はTS-1)を施行した当日又は数日後にPDTを施行した。PDTは気管支鏡下に直射型プローブ単独又は直射型+シリンドリカル型プローブを併用して腫瘍を照射し、気管支鏡とCTで定期的に治療効果を評価した。【結果】 PDT平均施行回数は3.4回 (1〜18回)であった、化学療法併用PDTを施行したことにより、気道狭窄率は治療前と比較し1週間後から有意に改善(p = 0.0003)し1ヶ月後も効果が持続(p = 0.0016)していた。全例治療後1週間以内の早期から自覚症状とQOL(Quality of life)が改善し、閉塞性肺炎を合併することなく経過できた、また、照射直後から止血効果も得られた。PDTに起因する合併症や死亡例はなく生存期間の中央値は9.3ヶ月間、1年生存率は30%だった。【結論】中枢気道狭窄・閉塞を伴う進行肺癌に対して化学療法併用PDTを施行し早期より気道を開大しえたので、今後、気道狭窄に対する化学療法併用PDTは安全かつ有用な治療法の一つの選択肢となる可能性があると考える。 | |
|---|---|---|
| キーワード | 進行肺癌、気道狭窄、閉塞性肺炎、Quality of life、化学療法併用PDT | |
| 『呼吸』eレポート 2(1) 34-46 ,2018 http://www.respiration.jp/erep/mokuji.php?y=2018&v=1 | ||
1.はじめに
肺癌の約30%に中枢気道狭窄が引き起こされるとされているが1)、進行肺癌が気道に浸潤し中枢気道狭窄を認めると比較的緩徐に進行する咳と急速に悪化する呼吸困難や閉塞性肺炎等が現れる。狭窄を伴う中枢気道の腫瘍の治療は、呼吸機能改善と腫瘍をコントロールする必要がある。しかし、進行肺癌による呼吸困難を伴う中枢性気道狭窄が起こった時には、手術による外科的切除と再建が標準的な治療法であるが、進行肺癌の場合は低肺機能や外科的切除不能な場合が多く1)2)、中枢性気道狭窄症例で外科的切除不能な場合は、姑息的治療として気道狭窄に対する気管支鏡的治療が症状緩和の低侵襲で有効な治療法で、呼吸困難や出血の原因となっている気道狭窄部の開通により気流制限の改善や止血が可能である。最も早い治療効果が期待できるのは腫瘍の機械的切除、Nd-YAG(neodymium-doped yttrium aluminum garnet)レーザー焼灼 、アルゴンプラズマ凝固(Argon Plasma Coagulation;APC)、マイクロ波凝固療法、高周波スネア、バルーン拡張、ステント留置などで、PDT、気管支腔内照射療法、凍結療法などは遅発性に効果が現れる。
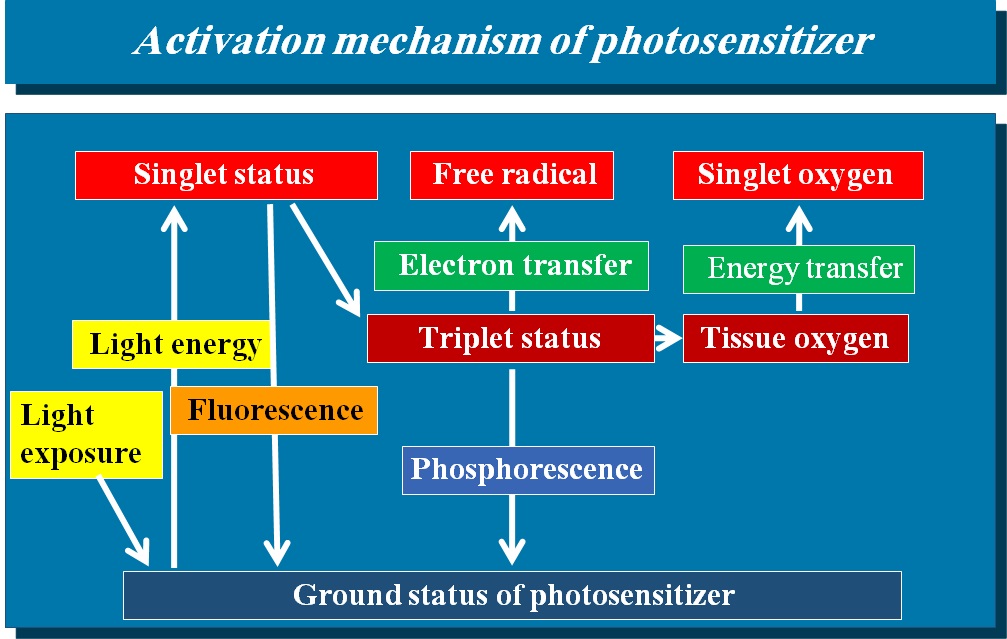
基底状態のPSが有効波長領域に暴露されると光のエネルギーを吸収し、高揚した励起一重項状態になりFree radicalを生じ(Type1)、不安定なPSが元の基底状態に戻る過程でエネルギー転換時に生じる一重項酸素と共に生体組織と反応して傷害を与えるメカニズムである(Type2)。
高出力のNd-YAGレーザーやAPCは気道狭窄病変を焼灼することにより腫瘍を蒸散し気道狭窄症状が直ぐに改善されるが、気管支穿孔や瘻孔形成により縦隔気腫や気胸、血管損傷による大出血、空気塞栓のリスクが高くなる。
また、腫瘍焼灼時に発生する煙を多量に吸引すると気管支喘息発作様の呼吸困難を起こすことがあり、遅発性に気管支内腔が肉芽やひきつれにより変形、狭窄することもある。さらに、呼吸不全を合併した状態では高濃度酸素投与中に焼灼しなければならないことも多いが、 Nd-YAG レーザーを気道内酸素濃度が35%以上、APCでは40%以上で施行すると腫瘍焼灼中に気道内で発火や熱傷の危険性もある。
一方、PDTは、腫瘍親和性光感受性物質(photosensitizer: PS)を投与後に低出力のレーザーを照射し、光化学反応により腫瘍退縮を得る治療法なので、高濃度酸素投与下でも施行可能で腫瘍選択性も高く穿孔のリスクが低いことに加え、効果を見ながら繰り返し治療が可能であるという利点がある。
またPDTによる殺細胞効果は、腫瘍細胞のアポトーシスや免疫反応、周囲の微小血管障害による細胞障害を起こして発揮されるが、化学療法により誘導されるサイトカインやDNA損傷といった相乗効果によりPDTの免疫学的細胞障害効果が増強されアポトーシスが促進するため、化学療法併用PDTがPDT単独療法より高い治療効果を発揮される3)。化学療法併用PDTは、リスクの高い中枢性気道狭窄病変を有する症例に対して安全な治療法の一つになり得ると考える。
2.PDTの治療機序
PDT(Photodynamic therapy:光線力学的治療)は高出力レーザーによる腫瘍の焼灼法とは異なり、光線力学的な光化学反応を利用して腫瘍を退縮させる方法である。その作用機序は、基底状態にある腫瘍親和性光感受性物質(PS)が有効波長領域の赤色光に暴露されると光のエネルギーを吸収し、高揚した励起一重項状態になる。励起された不安定な光感受性物質は蛍光などエネルギーを放出して元の基底状態に戻るが、この過程で一部が三重項状態に移項する。この状態で組織内の溶存酸素にエネルギーが転移されると励起状態の高まった一重項酸素が発生する。このとき腫瘍内でこの現象が生じれば、毒性の強い一重項酸素によって癌組織が破壊されることになる4)5)。この現象をエネルギー移項型(Type 2)といい、他方、三重項状態から電子変位(電子的移項型(Type 1))によるFree radicalの発生、それと溶存酸素が反応して腫瘍毒性につながるとも言われている(図1)。この活性酸素による直接的な殺細胞効果6)7)以外にも、直接的な作用、さまざまな二次性の免疫学的反応の誘導(間接的効果)、腫瘍あるいは周囲の血管を閉塞させる微小細血管障害(vascular shut down effect)やvascular endothelial growth factor(VEGF)発現の誘導などのメカニズムが複合的に重なりあって抗腫瘍効果を発揮すると考えられている6)8)。
本法が臨床応用されたのは1980年であったが、それ以降多くの報告がある9)。
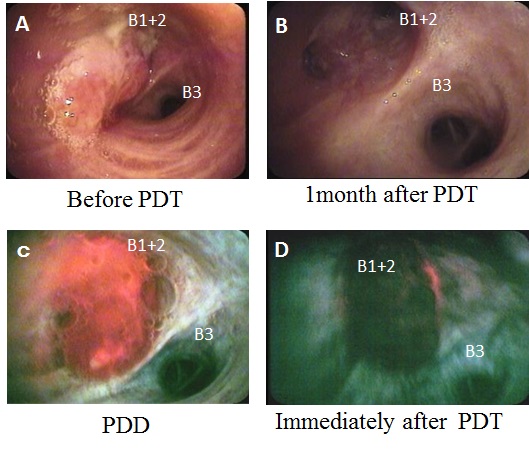
A.治療前、B.治療後、C.左上区支(B1+2)を閉塞する病変がレーザー照射前のSAFE-3000によるPDDで赤色画像として認識された。D.レーザー照射直後に赤色光が消失し治療効果を確認することできた。
3.PDTの方法
PSは、クロリン環を有する水溶性で408nmと664nmに吸収スペクトルを有する第二世代のタラポルフィンナトリウム(レザフィリン®: Meiji Seikaファルマ)を使用した。PSを静脈投与4~6時間後に、664nmのダイオードレーザー(PDレーザ: Meiji Seikaファルマ) で照射する。早期肺癌に対しては主に直射型プローブを用いて照射を行うが、進行肺癌では垂直方向にレーザーが照射可能な場合はまずマイクロレンズ付き直射型プローブを用いエネルギー密度100 J/ cm2で照射し、次に腫瘍選択性が高く正常組織への影響が少ないので、気道が腫瘍により閉塞・狭窄されて腫瘍を直接確認できない部位は腫瘍と気管支壁の間の接線方向に挿入したり、腫瘍内部に直接シリンドリカル型プローブを突き刺すような形で照射する。PDTは光化学反応により腫瘍退縮を得る治療法なので熱効果はなく高濃度酸素投与下でも施行可能である。
また、我々は自家蛍光気管支鏡(SAFE-3000)を用いて、PDTの施行前後に光線力学的診断(photodynanic diagnosis: PDD )も施行している。これはPSのレザフィリン®が664 nmの赤色レーザー光吸収領域以外にも408nmの青色レーザー光に対する吸収領域も有していることを利用し、PDTを施行する直前に病巣を408 nmのダイオードレーザーを有するSAFE-3000で観察すると、癌病巣内に蓄積したレザフィリン®が408 nmのレーザー光により励起され腫瘍内から発生する赤色光を確認してPDDで腫瘍範囲を正確に診断することが可能となる(図 2)10)11)。この自家蛍光気管支鏡は、早期肺癌はもとより気道狭窄・閉塞病変を合併した進行肺癌に対するPDT治療効果の判定のためにも大変有用な装置で、PDDにより癌病巣が赤色領域で観察されPDT施行直後に病巣の赤色光が消失する。このことを利用して、PDT施行直後にも病巣の赤色蛍光が残存するレーザーの照射が不十分な部位に追加照射の必要性を判断でき、いわゆる「あて損ない」を防ぐことが可能である10)。また、多少の出血があってもoozing程度であれば治療を開始してすぐに血管遮断効果により出血も少なくなる。
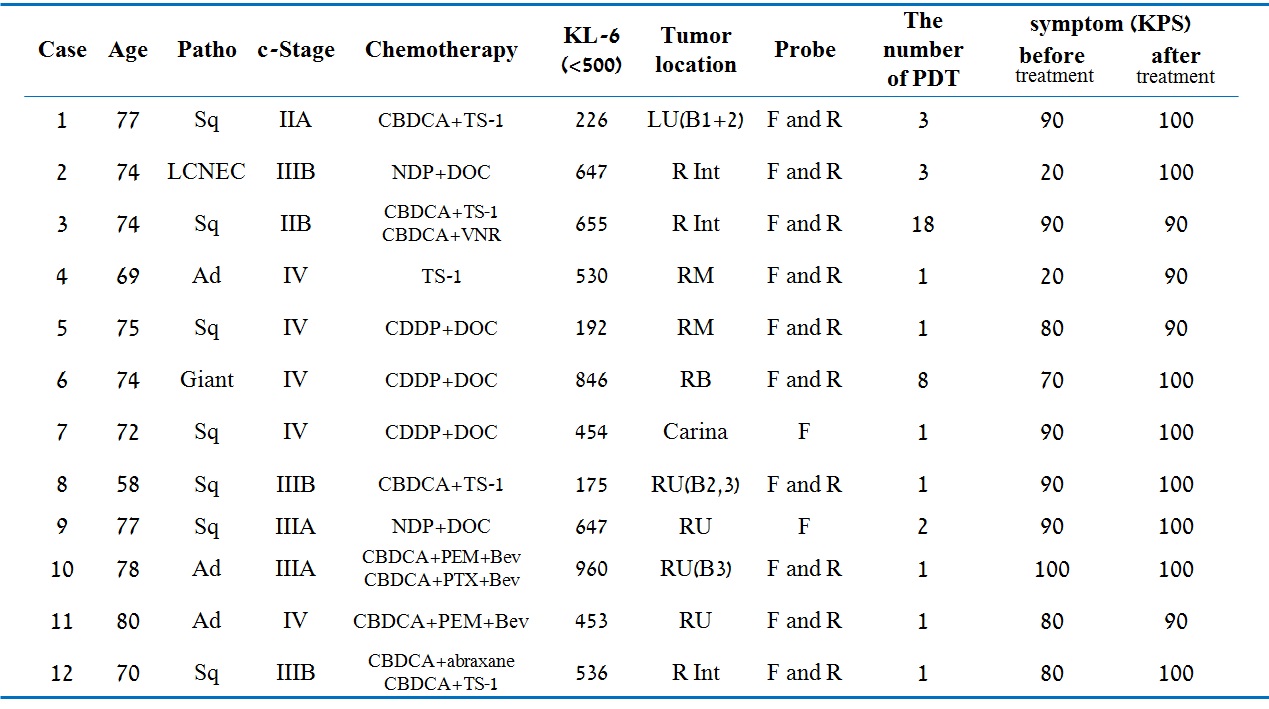
Ad; adenocarcinoma, Sq; squamous cell carcinoma, Giant; Gaiant cell carcinoma,
RM; Right main bronchus, RU; Right upper bronchus, R Int; Right bronchus intermedius,
RB; Right Basal bronchus, LU; Left upper bronchus, F; Frontal, R; radial, S.R; Stenosis rate, KPS; Karnofsky Performance Status.
4.化学療法併用PDTプロトコール
化学療法(プラチナダブレット又はTS-1)を施行した当日又は数日後にPDTを施行した。 PDTは、気管支鏡を用いマイクロレンズ付き直射型プローブ単独またはシリンドリカル型プローブを併用して腫瘍にレーザー照射する。病巣が広範である場合には、オリンピックマーク状に照射範囲を覆いかぶせるようにする。化学療法併用PDT施行の1週間後に気管支鏡で腫瘍を観察し、生検鉗子で壊死物質の除去を行い、1か月後に再度気管支鏡で腫瘍を観察した。その後の治療経過中に腫瘍の進行により気道の再狭窄を認めた場合には、化学療法併用PDTを繰り返し施行した。
化学療法併用PDTの侵襲は通常の気管支鏡検査と変わらず、4% キシロカインスプレーによる喉頭麻酔で前処置する。PDT施行中は血中酸素飽和度をモニタリング(PSの影響で低値に測定される)し必要に応じて酸素投与下に治療した。PS投与後は光線過敏症状が出現するため直射日光を避け、PS投与前から肌の露出部に市販の日焼け止めクリームを塗布して光線過敏症を予防した。PS投与後約1週間は直射日光を避ければ特に問題がないので外出も可能であるが12)、光線過敏症に留意し照度500ルクス以下の部屋で過ごすことが推奨されている。通常、遮光などしない普通の病棟が200ルクス以下、住宅でも窓際でなければ500ルクス以下といわれている。投与後2週間で日焼けはほとんど認められなくなる。
5. 対象
症例は、当院で2010年12月から2014年9月までに化学療法併用PDTを施行した、外科的切除困難な中枢性気道狭窄・閉塞病変と間質性肺炎などの合併症を伴う進行非小細胞肺癌12例であった。男性8例、女性4例、平均年齢73.3歳(58~80歳)、病期はstage IIA 1例、stage IIB 1例、stage IIIA 2例、stage IIIB 3例、stage IV 5例。組織型は扁平上皮癌7例、腺癌3例、大細胞神経内分泌癌1例、巨細胞癌1例。狭窄部位は、気管分岐部1例、右主気管支2例、右上葉支4例、右中間気管支幹3例、右底幹支1例、左上葉支1例であった。治療前の自覚症状は、咳嗽7例、喀痰6例(血痰3例)、呼吸困難3例、閉塞性肺炎3例、胸痛1例であった。全例喫煙者で、KL-6の上昇(>500)を7例で認め、平均526.8(175~960)であった(表 1)。
6.結果
化学療法併用PDT+の治療前と治療1週間後、1ヶ月後の気道狭窄の比率は、median 60%(30–100%)、 15%(15–99%)、15%(15–60%)で有意に改善していた(p=0.0003;治療前と治療1週間後、p=0.0016;治療前と治療1ヶ月)(図 3)。化学療法併用PDTによりKarnofsky Performanc
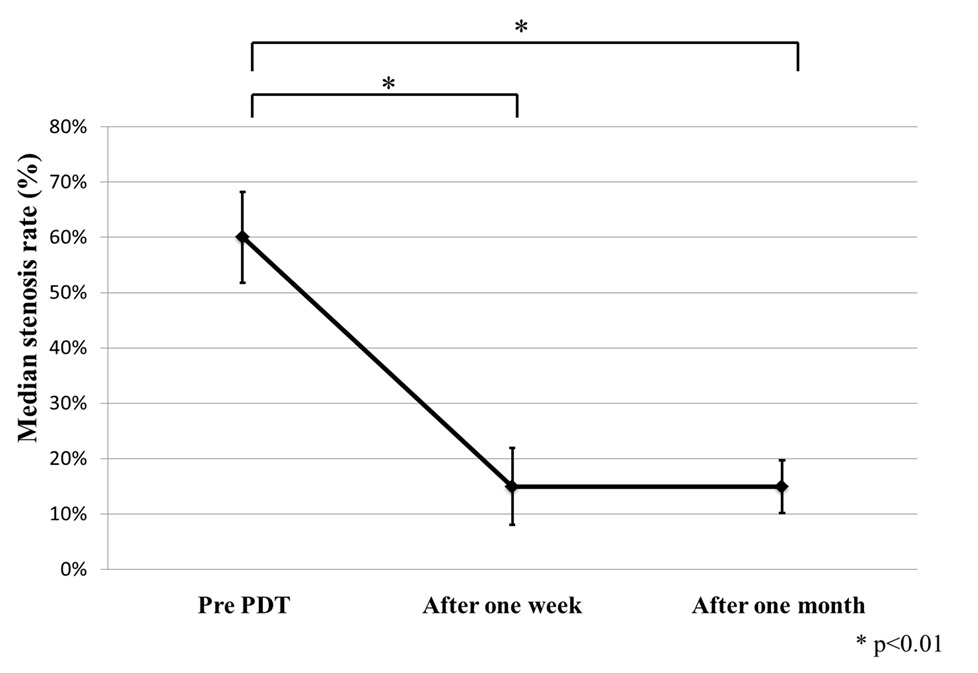
中枢性気道狭窄の治療前狭窄率(60%)が、1週間後(15%)に改善し1か月後(15%)も持続した。
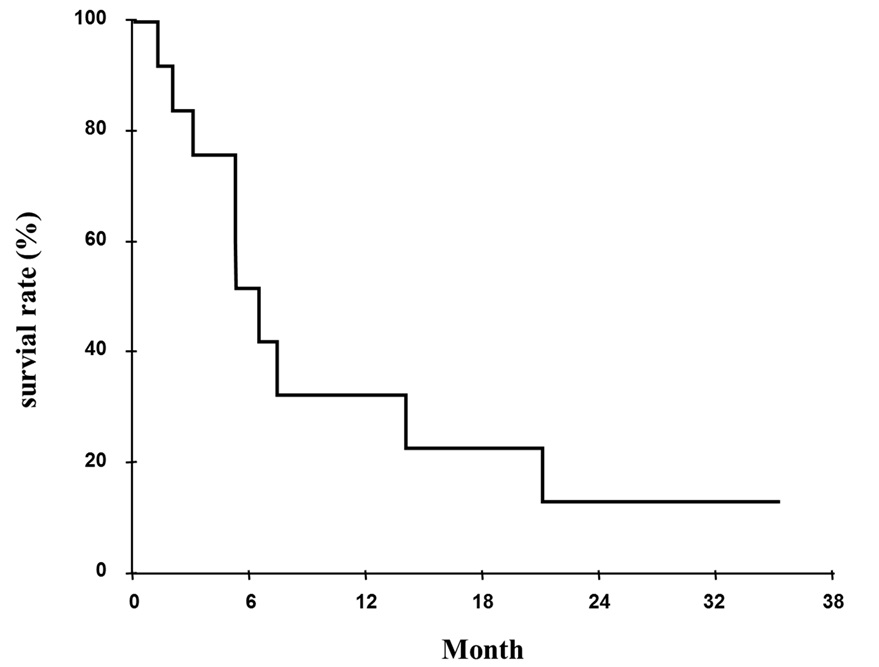
化学療法併用PDT後の中間生存期間(MST)9.3ヶ月、1年生存率30%
Status (KPS)が有意に改善された。KPSの変化は、治療前のmedian KPSが85 (20–100)であったが、治療1ヶ月後にはKPSが100 (90–100) に上昇した(表 1)。
また、化学療法併用PDTの1か月後には治療効果により気道が開大し閉塞性肺炎の合併を回避できたので、全ての症例で自覚症状とQOLが大幅に改善した。また、中枢気道狭窄を伴った進行癌に対して化学療法併用PDTを施行した症例の化学療法の奏効率は50%で、PR( partial response)6例、SD(stable disease)3例、PD(progressive disease)3例であり、中間生存期間(median survival time : MST)は9.3ヶ月間、1年生存率は30%であった(図 4)。副作用は、CTCAE Grade1:8例、Grade3:3例、Grade4:1例で、PDTに起因する副作用や死亡例はなかった。
PDT後に繰り返す閉塞性肺炎が改善した。
7.閉塞性肺炎を伴う中心型肺癌に
対する光線力学的治療施行例
対する光線力学的治療施行例
PDTの適応は、①病巣が区域気管支より中枢に位置する、②内視鏡的に病巣全体を確認できる、③気管支粘膜・粘膜下層に限局している、④リンパ節転移や遠隔転移を認めない腫瘍であるが、光感受性物質の進歩などにより腫瘍径が1.0cmを超える病巣でもcomplete response(CR)率は90.5%と高い奏功率であった10)。
中心型早期肺癌の特徴の一つは、同時性、異時性に多発することが多いことである。Usudaらは、PDTを施行した中心型早期肺癌症例の34.4%が多発肺癌だったと報告している13)。 レザフィリンを用いたPDTでは、664 nmという長波長のレーザー光を照射するため、深部まで治療可能で肺癌の浸潤が気管支粘膜下層~気管支軟骨までの中心型早期肺癌であれば、閉塞病変を伴っていてもPDT単独で根治することが可能である。
【症例1】
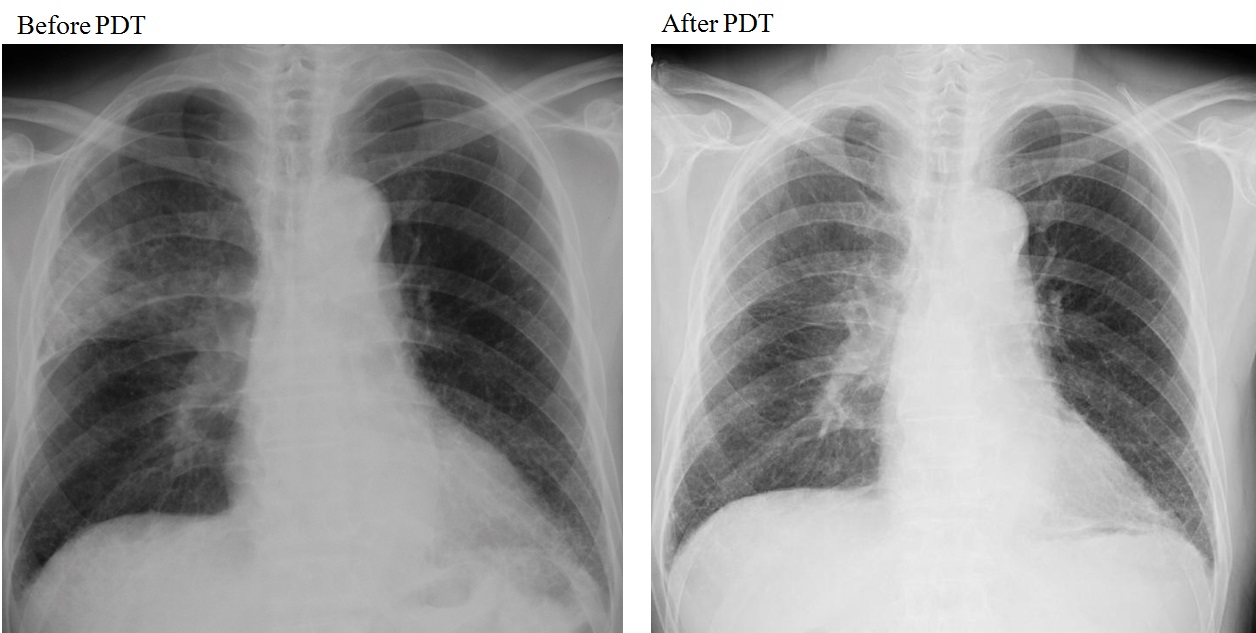
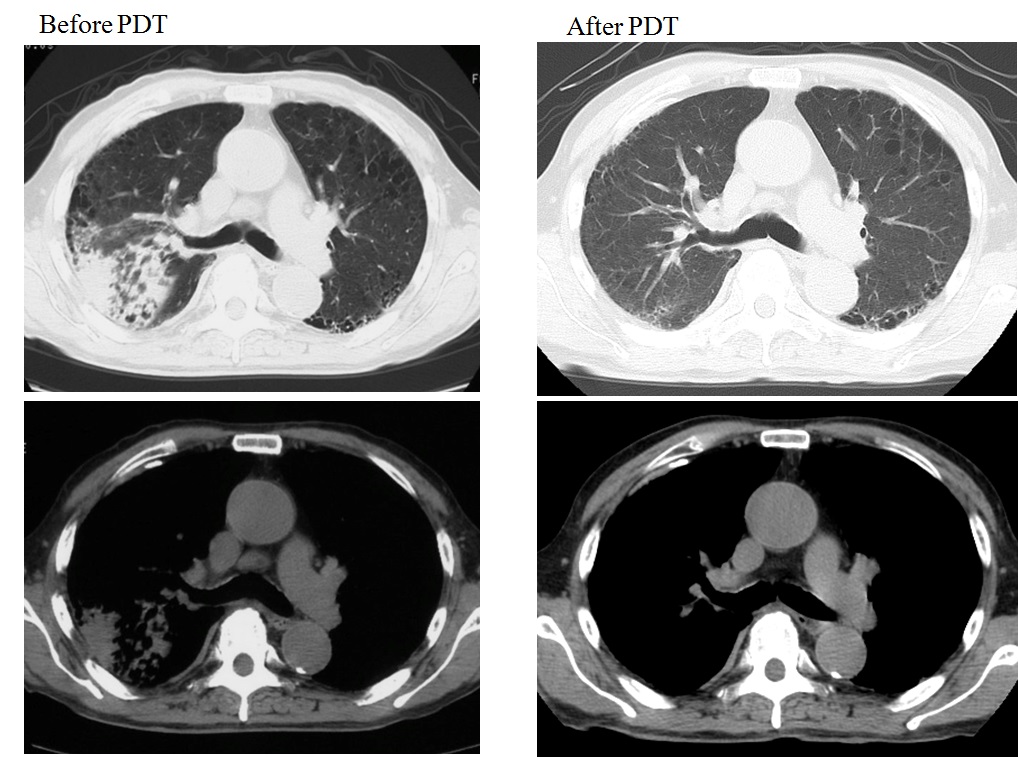
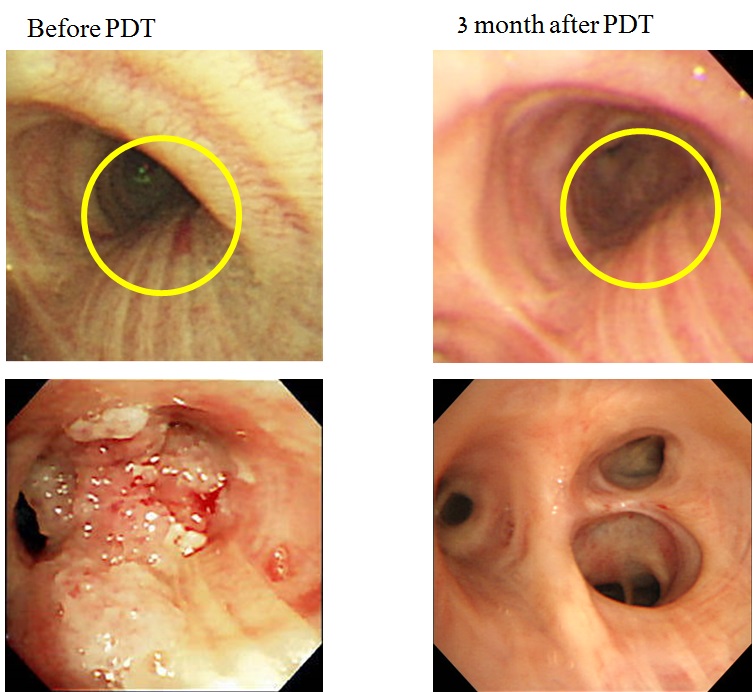
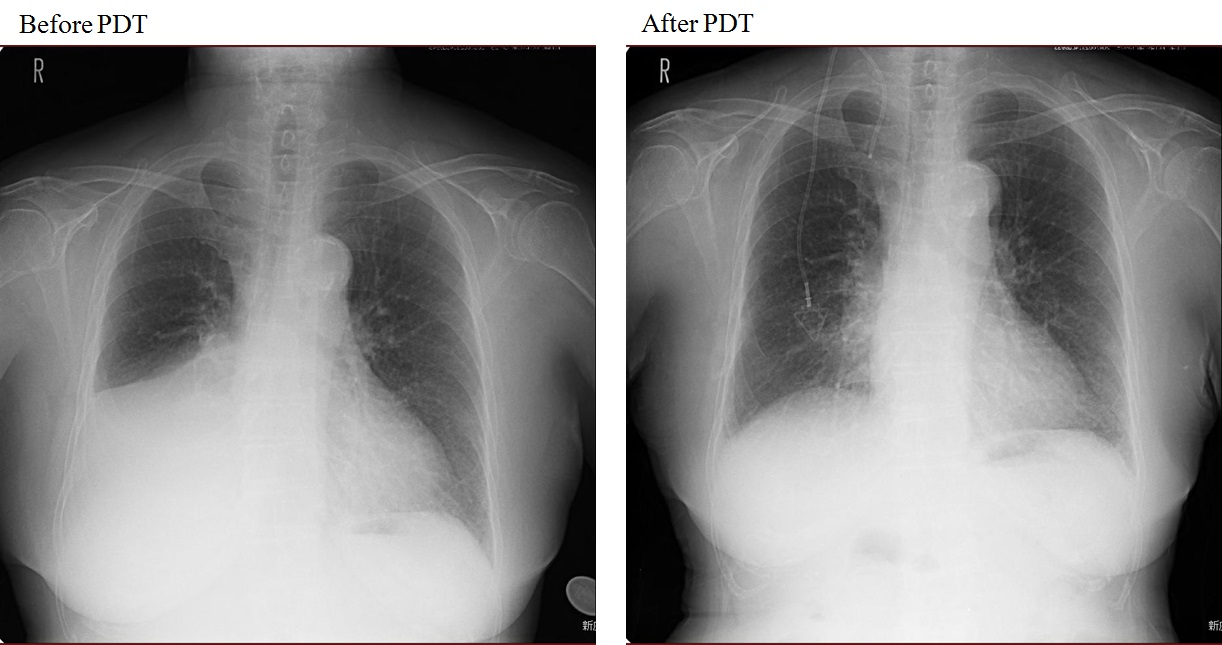
79歳男性。喫煙歴は、1日に20本、64年間。繰り返す右上葉肺炎の精査のために気管支鏡検査を施行し、右肺門部に同時多発した早期肺癌が発見された。気管支鏡所見は右主気管支膜様部の粘膜が肥厚し毛細血管が怒張していた平坦型早期肺癌と右上葉支入口部から区域支まで続く表面の不整、微小血管の増生、点状出血を認める結節型の中心型多発早期肺癌を認め、右上葉区域支がB1・B2を中心にほぼ閉塞していた。同部位に対して、直射型プローブを使用してダイオードレーザー(11分7秒、100J/cm²)を右主気管支膜様部に1回と右上葉支〜区域支にオリンピックマーク状に2回照射した。PDT治療後のレントゲン(図 5)、CTで肺炎の改善を認め(図 6)、PDT施行3ヶ月後の気管支鏡検査で右上葉区域気管支の開大と同部位の生検でCRを確認した(図 7)。
【症例2】
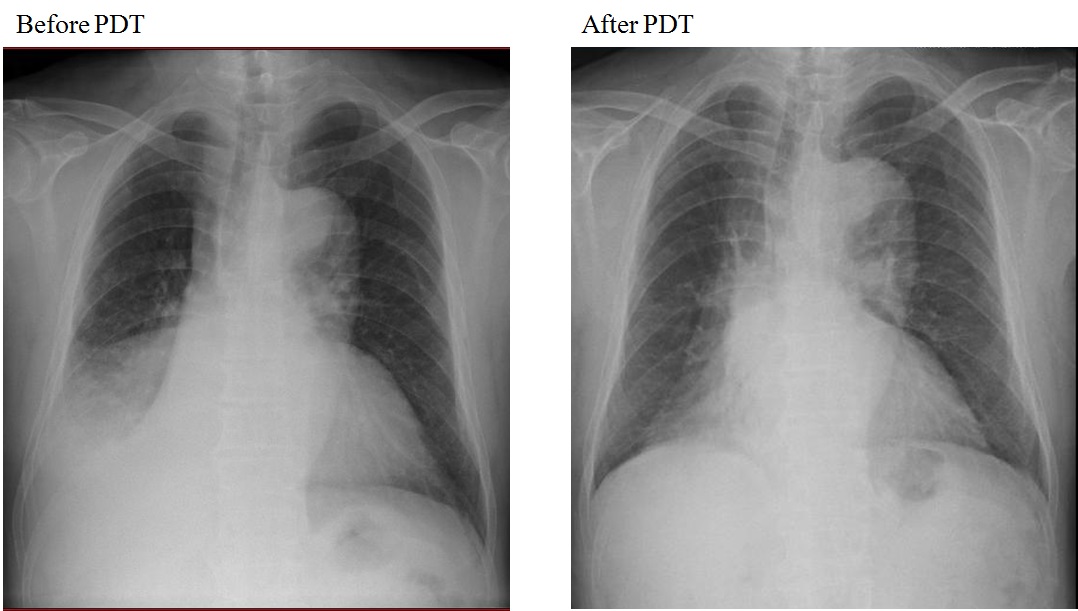
74歳男性。喫煙歴は、45年×20本/日。喘鳴、倦怠感、38℃の発熱を認め、胸部レントゲン、CTで肺気腫を合併した右下葉肺癌による右肺中下葉の閉塞性肺炎を確認した(図 8, 図 9)。気管支鏡検査にて、右中間気管支幹を閉塞する易出血性の大細胞神経内分泌癌(LCNEC: c-T3N2M0 c-stage IIIB)の診断を得た(図 10)。気道開大と進行肺癌の全身治療を目的とした化学療法併用PDT (NDP 100mg/㎡+DOC 60mg/㎡)を2回施行した。初回治療は、全身化学療法後3日目、レザフィリン40mg/m²静脈内投与4時間後にPDレーザを用いて励起光を照射した。初回PDTは、まず直射型プローブで垂直方向から照射後に腫瘍の周囲4か所にシリンドリカル型プローブで追加照射した。さらに、1ヶ月後にB6に残存した閉塞病変に対し、2回目の化学療法併用PDTを施行した。胸部レントゲン、CTで右中下葉無気肺の改善を認め(図 8, 図 9)、気管支鏡検査では気管支腔内の腫瘍も著明に縮小し肺癌により閉塞されていた気道が開通していた(図 10)。治療前の呼吸機能検査ではVC: 1.84L、%VC: 59%、FEV1.0: 1.28L、FEV1.0%: 69%と混合性換気障害を認めていたが、化学療法併用PDTの2回施行後の呼吸機能検査ではVC: 2.58L、%VC: 83%、FEV1.0: 1.67L、FEV1.0%: 75.9%と混合性換気障害の改善を認めた。
PDT後に右上葉区域支の腫瘍が消失し、閉塞性肺炎が改善した。
PDT後に右主気管支と右上葉区域支の多発癌が消失し、内視鏡的CRを得た。
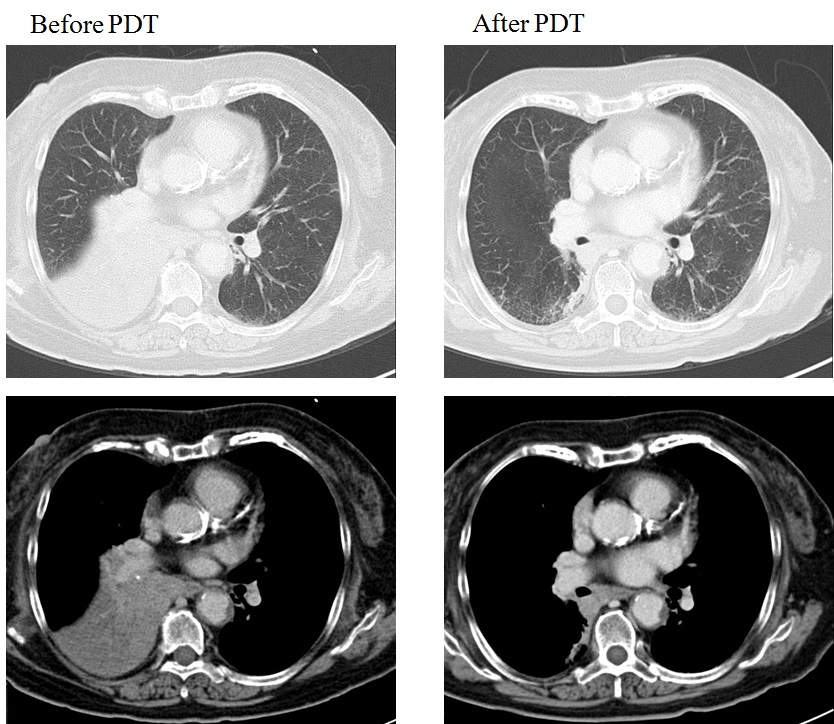
化学療法併用PDT後に右中下葉無気肺が改善した。
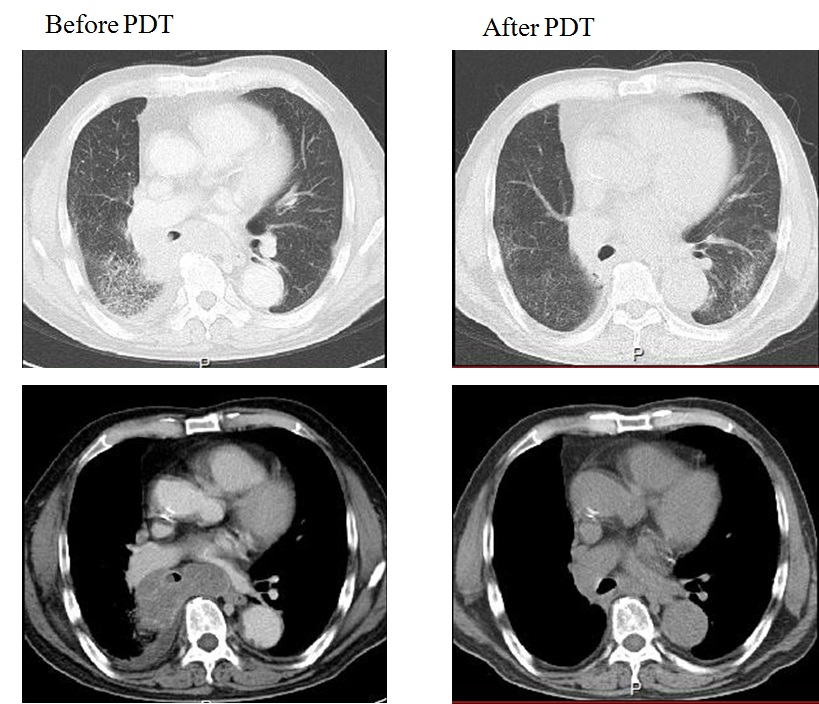
化学療法併用PDT後に右中間幹の腫瘍が著明に縮小し、右中下葉無気肺が改善した。
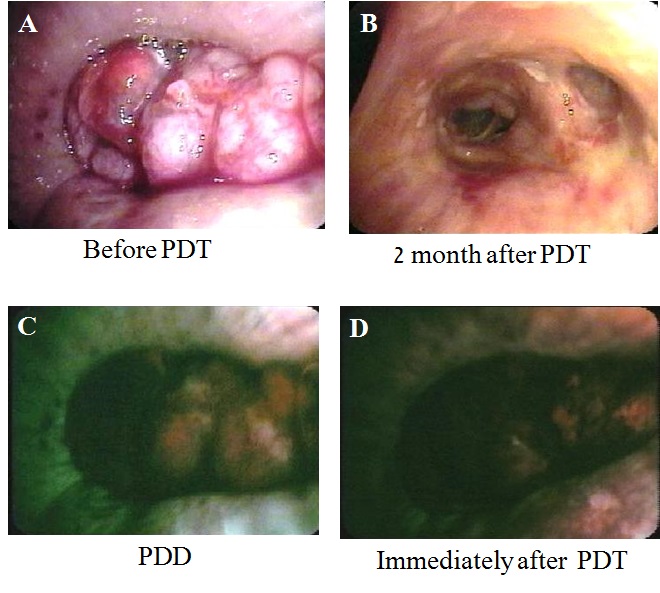
A.治療前、B.治療後、C.右中間気管支幹を閉塞する病変がレーザー照射前のSAFE-3000によるPDDで赤色画像として認識された。D.レーザー照射直後に赤色光が消失し治療効果を確認することできた。
化学療法併用PDT後に右中下葉無気肺が改善した。
【症例3】
70歳女性。喫煙歴は、54年×20本/日。呼吸苦を主訴に受診し、胸部レントゲン、CTで右下葉肺癌により右中下葉の無気肺を認めた(図 11,図 12)。気管支鏡検査にて、右中間気管支幹を閉塞する扁平上皮癌と診断した(c-T2bN3M0 c-stage IIIB)。気道開大と進行肺癌の全身治療を目的にPDTと同日に化学療法(CBDCA AUC=5+nab-PTX 100mg/㎡)を施行した。全身化学療法当日、レザフィ
化学療法併用PDT後に右中間幹の腫瘍が著明に縮小し、右中下葉無気肺が改善した。
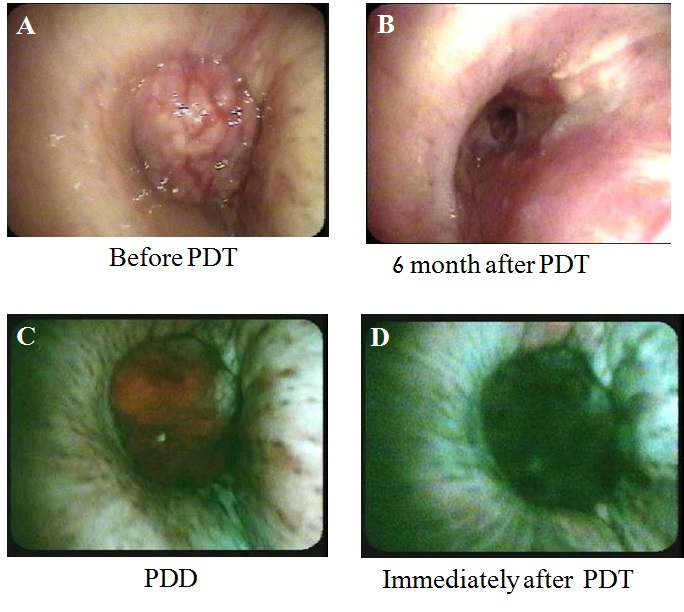
A.治療前、B.治療後、C.右中間気管支幹を閉塞する病変がレーザー照射前のPDDで赤色画像として認識された。D.レーザー照射直後に赤色光が消失し治療効果を確認することできた。
リンを静脈内投与4時間後にPDレーザを照射した。まず直射型プローブで照射した後に、腫瘍の周囲に4か所にシリンドリカル型プローブで照射した。化学療法併用PDT施行6か月後の気管支鏡検査では中間気管支幹腔内の腫瘍は消失し (図 13)、胸部レントゲン、CTで腫瘍の縮小(PR)と右中下葉無気肺の改善を確認できた(図 11,図 12)。治療前の呼吸機能検査はVC: 1.93L、%VC: 86%、FEV1.0: 1.28L、FEV1.0%: 73%と正常であったが、化学療法併用PDT施行後の呼吸機能検査ではVC: 2.51L、%VC: 110%、FEV1.0: 2.40L、FEV1.0%: 71.7%と改善を認めた。
8.考察
肺機能温存を考慮したPDTはQOLを損なうことなく可能な治療法であり、出血、穿孔といった合併症もなく、ハイリスク症例においても安全に施行可能である。
これまで、気道を狭窄・閉塞する進行肺癌に対して気道を開大する姑息的治療としてNd−YAGレーザー、APC、マイクロ波凝固法、気道ステント療法、放射線治療などが施行されてきた。 欧米では中枢気道狭窄の姑息的治療としてPDTを施行されてきたが14)、日本でも2010年4月から進行肺癌に対するPDTの保険診療が適応拡大され、早期肺癌の根治治療だけでなく気道狭窄や閉塞などを合併した進行肺癌に対して気道の開口を図り、呼吸困難などの臨床症状の改善する目的でPDTが施行可能となった。また、進行肺癌に対する治療法としてPDTとNd-YAGレーザーによる比較も様々に報告されており、Diaz-Jimenezらは気道閉塞の改善効果率では治療後1週目でPDT群 43%に対しNd-YAG群 53%と治療直後にはNd-YAG群の効果がやや優れていたが、1ヶ月後には38.5% 対23.5%と逆にPDT群の効果が持続され生存期間でもPDT群が優れていたと報告している15)。Nd-YAGレーザーによる焼灼よりもPDTによる治療の方が、腫瘍の再増殖までに要する時間が長いので、呼吸苦、咳嗽、喀血などの自覚症状の改善効果が比較的長期に認められた。 FurukawaらはNd-YAGレーザーでは肺炎、出血、穿孔などの合併症を起こしたが、PDTでは重篤な合併症を認めずに安全に施行することができ、進行肺癌に対するPDT の有用性を示した16)。さらに、PDTは副作用がほとんど無いので間質性肺炎を合併した症例等でも適応となり、他の治療法を妨げることもないため化学療法や放射線療法、手術等とのcombinationも可能で、効果を評価しながら繰り返しPDTを施行することもできる13)。
我々の中枢性気道狭窄を合併した進行肺癌に対して化学療法併用PDTの検討では、気道内の腫瘍の著明な縮小により1週間以内に血痰や閉塞性肺炎が軽快し、咳嗽、喀痰、呼吸困難等も1ヶ月以内には改善した。化学療法併用PDTは、肺癌により閉塞・狭窄した気道を開大させ気道狭窄による自覚症状とKPSの改善に適した治療と考えられる。また、野中らは、ヒト由来胆道癌細胞(NOZ)を移植したヌードマウスに化学療法とPDTを施行した基礎実験により、化学療法とPDTの単独療法と化学療法併用PDTの殺細胞効果をアポトーシス誘導効果と細胞増殖抑制効果、新生血管誘導効果によると報告しているが、化学療法やPDTの単独療法と比較し化学療法併用PDTはより高いアポトーシス誘導効果と細胞増殖抑制効果が確認され、さらに化学療法を併用することにより腫瘍部への低酸素障害を増強し新生血管の誘導を増加させる相乗効果が認められた17)。Parkらも43例の切除不能胆管癌において化学療法(S-1)併用PDTとPDT単独療法のRandomised phase II trialを施行し、化学療法併用PDTのPDT単独療法に対するOS(Overall survival)中央値17 vs. 8カ月およびPFS(Progression free survival)中央値10 vs. 2カ月の有意な延長を報告している18)。
今回、進行性肺癌による中枢性気道狭窄の比率が、化学療法併用PDTの治療前と比較して治療1週間後の早期から有意に改善し(p=0.0003)、治療1ヶ月後でもその効果が維持されていた(p=0.0016)。また、化学療法併用PDT治療前の呼吸機能障害も化学療法併用PDTにより治療2ヶ月後に改善していたことによりKPSも回復していた。 化学療法併用PDTを施行したことにより、治療後1週間の早期から1か月以上にわたり気道開大が維持され、閉塞性肺炎の合併を回避できた。全ての症例で自覚症状とQOLが大幅に改善しており、化学療法併用PDTを施行した症例の化学療法の奏効率も50%、MSTは9.3ヶ月間、1年生存率は30%と良好であった。
9.まとめ
化学療法併用PDTは局所麻酔下に軟性気管支鏡にて行い得る低侵襲な治療で、中枢性気道狭窄に対して化学療法との相乗効果によりPDTの気道開大の治療効果が早期から長期間維持されるので、閉塞性肺炎が回避できQOL向上に有意義と考える。呼吸困難等による化学療法の予定を変更することなく継続して施行できるので、生存期間の延長させる可能性が示唆された。間質性肺炎や低肺機能を合併した切除不能進行肺癌に中枢性気道狭窄を伴う症例での化学療法併用PDTの有用性と安全性が確認できたので、今後前向き研究が期待される。
1. Chin、 C.S.; Litle、 V.; Yun、 J.; Weiser、 T.; Swanson、 S.J. Airway stents. Ann. Thorac. Surg. 2008、 85、 S792–S796.
2. Venuta、 F.; Rendina、 E.A.; de Giacomo、 T.; Mercadante、 E.; Francioni、 F.; Pugliese、 F.; Moretti、 M.; Coloni、 G.F. Nd:YAG laser resection of lung cancer invading the airway as a bridge to surgery and palliative treatment. Ann. Thorac. Surg. 2002、 74、 995–998.
3. Nanashima A1.; Abo T.; Nonaka T.; Nonaka Y.; Morisaki T.; Uehara R.; et al. Photodynamic therapy using talaporfin sodium (Laserphyrin®) for bile duct carcinoma: a preliminary clinical trial. Anticancer Res. 2012 Nov、 32(11):4931-8.
4. Weishaupt KR.; Gomer CJ.; Dougherty TJ. Identification of singlet oxygen as the cytotoxic agent in photoinactivation of a murine tumor. Cancer Res. 1976 Jul、 36(7 PT 1):2326-9.
5. Niedre MJ.; Yu CS.; Patterson MS.; Wilson BC. Singlet oxygen luminescence as an in vivo photodynamic therapy dose metric: validation in normal mouse skin with topical amino-levulinic acid. Br J Cancer、 2005 Jan.
6. N. L. Oleinick.; R. L. Morris and I. Belichenko. “The role of apoptosis in response to photodynamic therapy: What、 where、 why、 and how、” Photochem. Photobiol. Sci.、 1(2001)1―21.
7. J. Usuda.; S. M. Chiu.; E. S. Murphy.; M. Lam.; A.-L. Nieminen and N. L. Oleinick. “Domain-dependent photodamage to Bcl-2; A membrane anchorage region is needed to form the target of phthalocyanine photosensitization、” J. Biol. Chem.、 278(2003) 2021―2029.
8. T. J. Dougherty.; C. J. Gomer.; B. W. Henderson.; G. Jori.; D. Kessel.; M. Korbelik.; et al. “Photodynamic therapy、” J. Natl. Cancer Inst.、 90(1998)889―905.
9. Kato H. Photodynamic therapy for lung cancer--a review of 19 years' experience. J Photochem Photobiol B. 1998 Feb、 42(2):96-9. Review.
10. Usuda J.; Ichinose S.; Ishizumi T.; Hayashi H.; Ohtani K.; Maehara S.; et al. Outcome of photodynamic therapy using NPe6 for bronchogenic carcinomas in central airways >1.0 cm in diameter. Clin Cancer Res. 2010、 16:2198- 2204.
11. Ikeda N.; Usuda J.; Kato H.; Ishizumi T.; Ichinose S.; Otani K.; et al. New aspects of photodynamic therapy for cen- tral type early stage lung cancer. Lasers Surg Med. 2011、 43:749-754.
12. Usuda J.; Tsutsui H.; Honda H.; Ichinose S.; Ishizumi T.; Hirata T.; et al. Photodynamic therapy for lung cancers based on novel photodynamic diagnosis using talaporfin sodium (NPe6) and autofluorescence bronchoscopy. Lung Cancer. 2007 Dec、 58(3):317-23. Epub 2007 Aug 15.
13. Usuda J.; Ichinose S.; Ishizumi T.; Hayashi H.; Ohtani K.; Maehara S.; et al. Management of multiple primary lung cancer in patients with centrally located early cancer lesions. J Thorac Oncol. 2010、 5:62-68.
14. Bolliger CT.; Mathur PN.; Beamis JF.; Becker HD.; Cavaliere S.; Colt H.; et al. ERS/ATS statement on interventional pulmonology. European Respiratory Society/ American Thoracic Society. Eur Respir J. 2002、 19:356-373.
15. Diaz-Jiménez JP.; Martínez-Ballarín JE.; Llunell A.; Farrero E.; Rodríguez A.;Castro MJ. Efficacy and safety of photodynamic therapy versus Nd-YAG laser resection in NSCLC with airway obstruction. Eur Respir J. 1999、 14:800-805.
16. Furukawa K.; Okunaka T.; Yamamoto H.; et al. Effectiveness of Photodynamic Therapy and Nd-YAG Laser Treatment for Obstructed Tracheobronchial Malignancies. Diagn Ther Endosc. 1999、 5:161-166.
17. Nonaka Y.; Nanashima A.; Nonaka T.; et al. Synergic effect of photodynamic therapy using talaporfin so- dium with conventional anticancer chemotherapy for the treatment of bile duct carcinoma. J Surg Res 2013、 181: 234-241.
18. Park DH.; Lee SS.; Park SE.; Lee JL.; Choi JH.; Choi HJ.; et al. Randomised phase II trial of photodynamic therapy plus oral fluoropyrimidine、 S-1、 versus photodynamic therapy alone for unresectable hilar cholangiocarcinoma. Eur J Cancer. 2014 May、 50(7):1259-68.