アレルギー性気管支肺真菌症の新知見
Update of allergic bronchopulmonary mycosis
| 浅野 浩一郎 | 東海大学医学部内科学系呼吸器内科学 |
| Koichiro Asano | Division of Pulmonary Medicine, Department of Medicine, Tokai University School of Medicine |
| 要 旨 | アレルギー性気管支肺真菌症(Allergic bronchopulmonary mycosis, ABPM)は主に成人喘息患者でみられ、分生子(胞子)として吸入された真菌(糸状菌)が気道内で発芽・腐生し、Ⅰ型・Ⅲ型アレルギー誘導と気道内の好酸球性粘液栓形成を介して発症する疾患である。原因真菌としてはアスペルギルス・フミガータスが多いが、これは分生子のサイズ、至適発芽温度、真菌の持つプロテアーゼ活性などが関与する。インドから多数の報告がなされているが、日本のABPMとは臨床像にいくつか重要な違いがあることに注意が必要である。治療には経口ステロイド薬、抗真菌薬などがあるが、治療の長期化に伴う合併症や薬剤耐性誘導などが危惧されることから、さらに新しい治療法の開発が期待されている。 | |
|---|---|---|
| キーワード | アスペルギルス・フミガータス、喘息、免疫グロブリンE、好酸球 | |
| 『呼吸』eレポート 2(2) 59-66 ,2018 http://www.respiration.jp/erep/mokuji.php?y=2018&v=2 | ||
概 要
アレルギー性気管支肺アスペルギルス症(allergic bronchopulmonary aspergillosis; ABPA)は1952年にHinsonらによってはじめて提唱された疾患概念である1)。外科切除あるいは剖検肺の所見から気管支肺アスペルギルス症(bronchopulmonary aspergillosis)として報告された8例のうち4例は、1)気管支炎(bronchitis、喘息病態を示唆していると思われる)、2)好酸球増多(eosinophilia)、3)気管支拡張(bronchiectasis)/粘液栓(mucus plugs)、4)アスペルギルス・フミガータス(Aspergillus fumigatus)の検出、を伴っており、現在のABPAであったと考えられる。
主に成人喘息患者でみられる疾患で、分生子(胞子)として吸入された真菌(糸状菌)が気道内で発芽・腐生することでⅠ型アレルギーとⅢ型アレルギー反応を誘発し、発症する2,3)。欧米では嚢胞線維症患者に合併することも多い。臨床的には末梢血好酸球数の増加や高IgE血症、アスペルギルス・フミガータス特異的IgE抗体・IgG抗体・沈降抗体陽性、アスペルギルスに対する即時型皮膚反応陽性などがみられ、画像所見では、移動性の浸潤影、中枢性気管支拡張(central bronchiectasis)、気管支内粘液栓が特徴的である。再発を繰り返し、放置すれば肺の線維化から呼吸不全に至る4)。顕在例以外にも重症喘息とされている潜在例が多いとされる。
病 態
真菌由来の抗原にはプロテアーゼ活性など抗原・アレルゲンとして作用しうるものが多く含まれているため、空中浮遊真菌の吸入は様々な免疫応答を誘導し、喘息や過敏性肺炎など様々な免疫アレルギー性気道疾患を引きおこすが、ABPMの発症には生きている真菌を吸入することが必須である。ただし、真菌感染症とは異なり真菌は生体組織には侵入しておらず、気管支腔内の粘液栓にのみ認められる。その発症過程では、まず第1段階として分生子を吸入すること、第2段階としてその分生子が気道内で発芽し菌糸を形成すること、第3段階として菌糸が生体側の免疫応答を惹起すること、第4段階として気道内に真菌菌糸を含む好酸球性粘液栓が形成されること、が病態形成に重要な役割を果たす。
原因真菌
アスペルギルス・フミガータスが原因真菌となることが多いが、他のアスペルギルス属真菌(アスペルギルス・フラバスなど)やペニシリウム(Penicillium)属、キノコ(真性担子菌)の一種であるスエヒロタケ(Schizophyllum commune)などの他の糸状菌でも発症する5)。アスペルギルス属以外の原因真菌によって発症した場合には、アレルギー性気管支肺真菌症(allergic bronchopulmonary mycosis; ABPM)とよばれる。

ただし、最も報告が多いカンジダ・アルビカンス(Candida albicans)によるとされているABPM症例は、おそらく多くが別の真菌によるものを誤診していると思われる。カンジダ・アルビカンスは口腔内常在菌として喀痰に高頻度で混入し、健常人も含めて血清抗体陽性率も高いため、真の原因真菌を同定できなかった場合に誤って原因真菌と判断されてしまう可能性が高い。しかしカンジダ・アルビカンスは酵母様真菌であり、糸状菌のように菌糸を出すことがないため、実際にABPM病態をつくりうるか疑問である。
吸入アレルゲンとして作用する代表的真菌には、アスペルギルス属、ペニシリウム属以外にアルテルナリア(Alternalia)属、クラドスポリウム(Cladosporium)属がある。後2者は主に屋外アレルゲンであり、神奈川県相模原市での屋外浮遊真菌数の検討では、クラドスポリウムが24.9%、アルテルナリアが12.0%を占め、他の真菌はいずれも3.0%未満と少なかった6)。さらに屋内真菌としてもアルテルナリアやクラドスポリウムの方が他の真菌よりも多く検出されたとの報告もある。しかし、アルテルナリア属やクラドスポリウム属によってABPMを発症することは稀である。
原因真菌の特性
上述のような原因真菌の偏りは、大気中真菌量や喘息患者での真菌感作の生じ易さの違いでは説明できない。例えば英国の重症喘息コホートに含まれる患者ではアスペルギルス(36%)、ペニシリウム(21%)の感作率は高いが、アルテルナリア(19%)、クラドスポリウム(15%)への感作率も必ずしも低くない7)。
この違いは真菌分生子の大きさの違いである程度説明できる。アルテルナリアの分生子は25~60 x 3~3.5 µmと大きく、クラドスポリウムの分生子には3~7 x 2~4 µmくらいの小型のものもあるが、一般には15~25 x 7~10 µmとやや大きい。一方、アスペルギルスやペニシリウムの分生子は3~6 µm大の球形であり、下気道まで容易に到達しうる。スエヒロタケの分生子のサイズも3~4 x 1~1.5 µmと小型である。
もう一つのABPMの原因真菌となるための条件は、ヒトの体温下でも発芽できることである。一般的な真菌の至適発芽温度は18~22℃と室温に近く、アスペルギルス属でもアスペルギルス・ナイジャーの至適発芽温度は30℃程度であるが、アスペルギルス・フミガータスの至適発芽温度は37~42℃とヒトの体温と同程度であるため、下気道内で発芽して菌糸を形成することが容易である8)。スエヒロタケの至適発芽温度も30~35℃であり、そのためにABPMの原因真菌となり得る9)。
生体側の細胞との相互作用についても、真菌による違いが存在する。我々がアスペルギルス・フミガータス、ペニシリウム、アルテルナリアの3種類の真菌抽出物で気管支上皮細胞株を刺激した際に発現が誘導される遺伝子をDNAマイクロアレイ法で検討したところ、複数の真菌で共通に発現誘導される遺伝子と、特定の真菌でのみ誘導される遺伝子があることが判明した10)。アスペルギルス・フミガータス特異的に誘導される遺伝子にMuc5acがあり、これはムチン遺伝子の一つである。このようなムチン産生誘導は、アスペルギルス・フミガータスの持つセリンプロテアーゼ活性依存性であり、それによって上皮細胞膜のTNFα-converting enzymeが活性化され、細胞膜結合型transforming growth factor-α(TGF-α)を切断して上皮増殖因子受容体を活性化する。アスペルギルス・フミガータスによるこのようなムチン産生促進効果が真菌の定着、発芽により適した局所環境をつくっていると想定される。他の真菌ではこのようなセリンプロテアーゼ活性が低く、例えばアスペルギルス属でもアスペルギルス・ナイジャーのセリンプロテアーゼ活性は低い11)。
表1に代表的な真菌の生物学的特性と、各真菌がきたしうるアレルギー性気道疾患をまとめた。様々な真菌が真菌感作重症喘息や上気道(副鼻腔)病変であるアレルギー性真菌性鼻副鼻腔炎をきたしうるが、ABPMをおこすには前述のように小さい分生子、高い温度での発芽、強いプロテアーゼ活性などの条件が揃うことが必要である。
ABPMの病理像からみた病態
ABPMの形態学的特徴として,i)好酸球性粘液栓(allergic mucin)が気管支内に嵌頓する像(mucoid impaction of bronchi),ii) 粘液栓を有する気管支の拡張(中枢性気管支拡張),iii) 上記病変の末梢肺に見られる気管支中心性肉芽腫症、好酸球性肺炎,器質化肺炎など,中枢気管支から末梢肺に及ぶ多種の病変が挙げられてきた12)。1988年にBoskenらはこれら所見を整理し,形態学的なABPMの診断基準を提唱した13)。具体的には,好酸球性粘液栓もしくは高度の好酸球浸潤を伴う気管支中心性肉芽腫症が確認され,病変内に組織侵襲を示さない真菌が見出された場合,ABPMとして診断してよいとするものである。
蛇澤ら14)はABPMの肺葉切除標本を対象とした病理像の検討により,多彩な病変のうち最も古い病変は好酸球性粘液栓であり、それが大きくなる過程で好酸球性炎症により脆弱化した気道壁を伸展することで中枢性気管支拡張が形成されること、気管支中心性肉芽腫症、好酸球性肺炎,器質化肺炎などの末梢肺の病変は、好酸球性粘液栓から真菌もしくは真菌の産生物が経気道的に散布されたことにより引き起こされる二次的病変であることを提唱した。つまり、ABPMの一義的な病変は診断基準に含まれている中枢性気管支拡張や肺浸潤影ではなく、好酸球性粘液栓である14)。好酸球性粘液栓が既存構造を外側に圧排するという考え方は、上気道に生じるアレルギー性真菌性鼻副鼻腔炎において、副鼻腔内に充満した好酸球性粘液栓が副鼻腔周囲の骨構造を外方に偏位させる病態も良く説明しうる。
好酸球性粘液栓には組織学的にはフィブリンの滲出とともに,多数の好酸球やCharcot-Leyden結晶の集簇した構造物が多数認められ,手術例で気管支内に嵌頓している粘液栓は樅の木様構造を示す。真菌は粘液栓内に散見されるが、慢性肺真菌症に見られる菌塊のように真菌が密に集簇することはない。
好酸球粘液栓の特性とABPMの病態
このような好酸球性粘液栓の特性が生じる機序として、好酸球のextracellular trap cell death(ETosis)の関与が注目されている。ETosisはもともとは好中球が核内のクロマチンとともに顆粒蛋白を放出し(neutrophil extracellular traps: NETs)、殺菌作用を発揮するメカニズムとして報告された15)。真菌に対しても好中球はETosisをおこすが、最近の研究ではNETsに殺真菌作用はないことが明らかになっている16)。
好中球以外の細胞もETosisをおこしてクロマチンを細胞外に放出するが、好酸球も同様である。Uekiらは好酸球のETosisについて精力的に検討を行っている17)。DNAの物性としてextracellular trapは粘稠であるが、好酸球が放出するextracellular trapは好中球が出すそれより凝集した構造をとり、好酸球性粘液栓が特に粘稠度が高いことを裏付けている。ABPAの好酸球性粘液栓内においても細胞外に放出されたDNAとシトルリン化されたヒストンがみられ、好酸球のETosisが関与していることを示唆している(図1)18)。
ABPAの臨床像 東アジアと南アジアのABPAの違い
表2に日本、韓国、インドから報告されたABPAコホート研究で報告された臨床像をまとめた19-28)。Agarwalらの研究では喘息を必須、Ogumaらの研究では中枢性気管支拡張か粘液栓を必須としているなど、各研究毎に症例の診断基準が異なることから一律には比較できないが、日本・韓国などの東アジアでの臨床像とインドにおける臨床像にはいくつか明白な違いがある。
(1)年齢・性別
最も大きな違いはABPA患者の年齢である。従来、ABPAの好発年齢は30歳代と考えられ、インドでのABPAの臨床像に良く合致する19-21,25)。一方で、日本、韓国のABPA患者の年齢中央値は50~60歳代であり22-24,26)、発症年齢の報告があるOgumaらとKimらの報告ではいずれも中央値が50歳代である23,24)。Ogumaらの日本での全国調査結果をみると、50歳以降でABPAを発症した症例が全体の2/3を占める24)。
このような違いが生じる原因として3つの可能性が考えられる。第一の可能性としてはABPAの発症ピークが30歳代とより高齢層との2つあり、人口分布の違いからインドでの検討では若年者のピークが強調され、高齢化している日本・韓国では高齢者でのピークがより強調されているという可能性である。日本の全国調査のデータを用いたクラスター解析を行うと、発症年齢の異なる3つのクラスターに分類でき、発症年齢の中央値がそれぞれ30歳代、50歳代、60歳代となる(未発表データ)ことは、この仮説を支持する。第2の可能性として、ABPAの先行病態としての喘息の発症自体が東アジア人では遅いのかもしれない。実際に重症喘息コホート研究での検討でも、日本、韓国の重症喘息の発症年齢は40歳前後と、米国や欧州と比較して高年齢化している。第3の可能性として、環境真菌への暴露量によって感作時期が異なり、発症年齢が変化する可能性である。インドにおいては他の地域と比較して喘息患者におけるABPAの発症率がとびぬけて高く、環境要因としての真菌暴露量が多いことが示唆される。そのような環境下ではより早期にABPAを発症するのかもしれない。
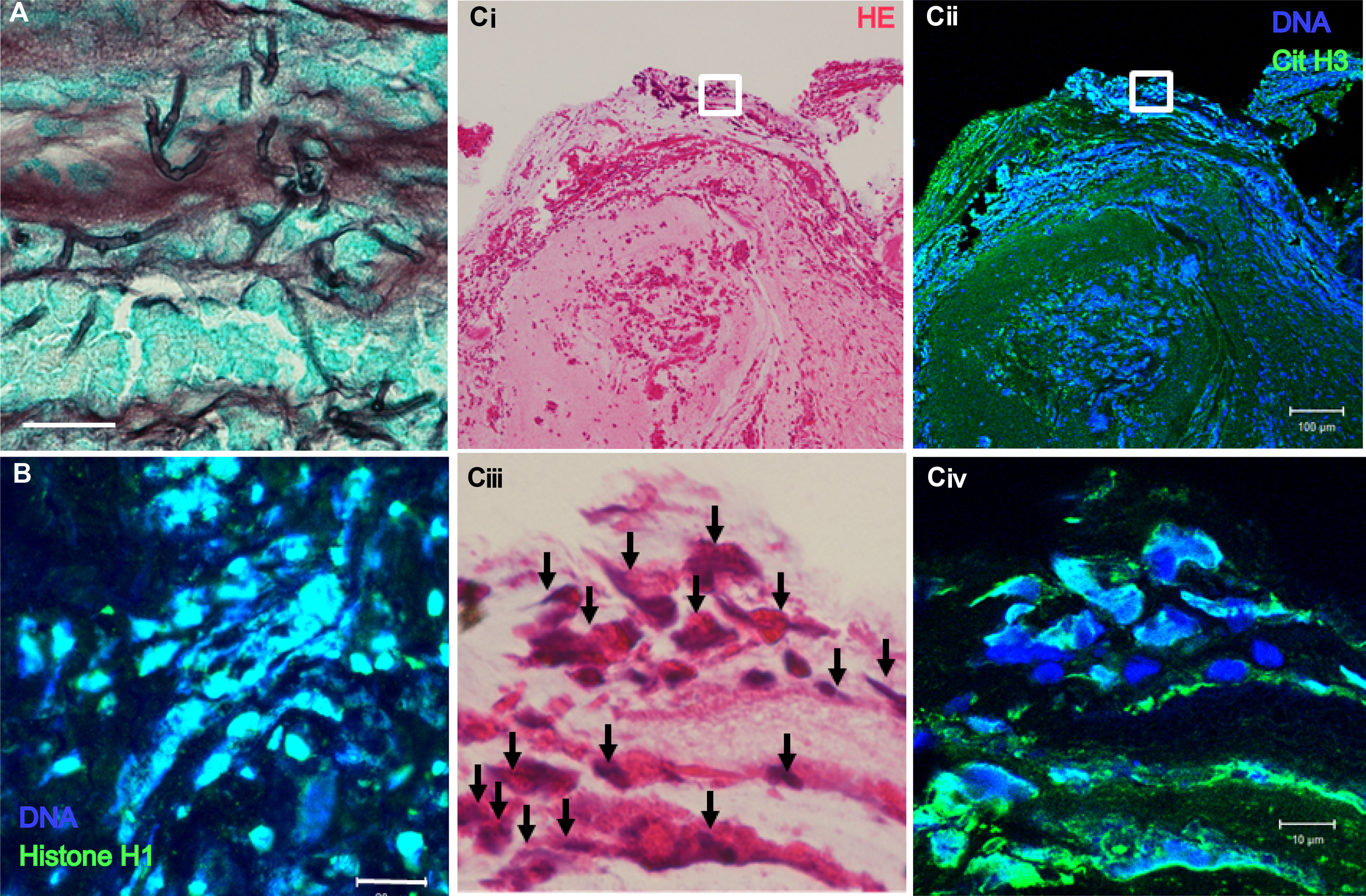
(A) ABPA患者の粘液栓内には真菌菌糸がみられる(グロコット染色)。(B) DNA(青)とヒストンH1(緑)で染めると、細胞外にメッシュ状のextrecellular trapが確認できる。(C) HE染色(Ci, Ciii)で崩壊した核を示す好酸球周囲には、DNA(青)とシトルリン化ヒストンH3(緑)で染色されるextrecellular trapが確認できる(Cii, Civ)。
(文献18より許可を得て転載)
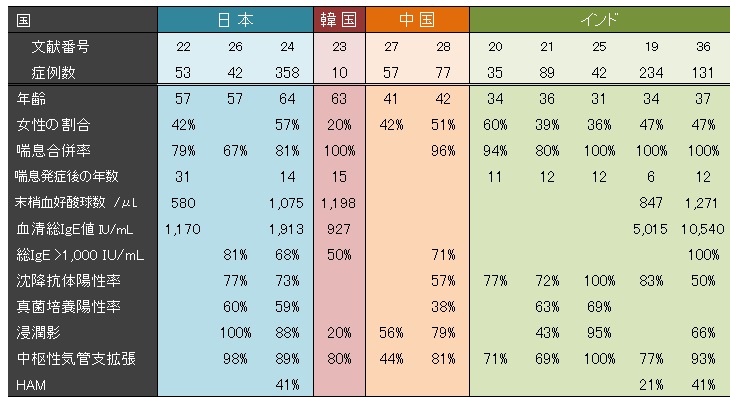
HAM:high attenuation mucus
(文献3より許可を得て転載)
(2)背景疾患
欧米ではABPAの背景疾患として嚢胞性線維症が多いが、アジア人では本疾患は極めて稀であり、本稿では割愛する。
既存の診断基準では気管支喘息の併存はその診断のための項目の一つとして取り上げられており、気管支喘息(または嚢胞性線維症)の存在を診断のpredisposing conditionとしている診断基準も存在する。しかし以前より気管支喘息を合併しないABPAも存在することが報告されており29)、日本における全国調査では喘息・嚢胞性線維症を合併しない症例を約20%に認め24)、他の日本やインドのコホートでも同程度の合併率が報告されている。病理学的に診断したABPM症例の検討では17例中7例(41%)で喘息・嚢胞性線維症を合併していなかったとする報告もある22)。
小児期には喘息を合併していてもABPAを発症することは稀であり、ほとんどの場合は15歳以降に発症する。インドでは、小児喘息患者に発症したABPA症例が報告されているが30)、我が国での調査では15歳未満で発症した症例はみられなかった24)。このことは、好酸球性副鼻腔炎・中耳炎や慢性好酸球性肺炎などの好酸球性上・下気道疾患がいずれも成人発症であることと奇妙に合致する。アスピリン喘息(Aspirin exacerbated respiratory disease)や重症喘息のフェノタイプである好酸球優位型喘息も同様に好酸球増多を伴うことが多く、成人になってから発症することが特徴である。これらの成人発症好酸球性気道疾患に共通する病態があることが示唆される。
(3)血清総IgE値
血清総IgE値が本疾患患者では上昇していることが知られ、その診断のみならず、病勢の把握に用いられる。現在まで報告されてきた診断基準などではカットオフ値は >417IU/ml、>1,000 IU/mlなどが提唱されてきた。米国アレルギー・喘息・免疫会議の会員のABPAアンケート調査では、44.9%の医師が417IU/mL、42%の医師が1000 IU/mLを採用していたなど、まちまちである31)。1,000 IU/mLをカットオフ値とした際には平成25年度の本邦におけるABPM全国調査の症例の33%で基準値以下となるため、注意が必要である。なお、血清総IgE値は疾患活動性の評価に有用であることが知られており、25~50%の減少が治療の目安とされている。
(4)真菌培養
喀痰培養によってアスペルギルス属が検出される頻度は培養条件によって左右される可能性があるが、多くの検討で60%~70%である。日本のABPAの特徴として喀痰からスエヒロタケも検出される場合が10%前後ある。
診 断
喘息患者において末梢血好酸球数や血清IgE濃度が高く、アスペルギルス特異的IgEが陽性である場合、あるいは喘息の既往の有無にかかわらず末梢血好酸球数増多を伴い肺野に浸潤影、中枢性気管支拡張、あるいは気管支粘液栓を認める場合などには、ABPAを疑って精査を行う必要がある。
本疾患の診断基準としては、1977年に発表されたRosenbergらの診断基準によってABPAが疑われた20症例を基に提案された基準が長年用いられてきた32)。①喘息、②末梢血好酸球増多、③アスペルギルス抗原に対する即時型皮膚反応陽性、④アスペルギルス抗原に対する沈降抗体陽性、⑤血清総IgE値上昇、⑥肺浸潤影の既往、⑦中枢性気管支拡張、からなり、7項目全てを確実例、①〜⑥の6項目を満たす場合をほぼ確実例とする。この診断基準は特異度は高いが、感度が低い。その後1988年に、PattersonやGreenbergerらによって中枢性気管支拡張を伴うABPA-central bronchiectasisに加えて、早期病態として血清学的に診断されるABPA-seropositiveも提唱された33)。2013年には、ISHAM(International society for human animal mycology)が新しい診断基準を提案した2。喘息あるいは嚢胞線維症を有する症例で、①アスペルギルス抗原に対する即時型皮膚反応陽性あるいは特異的IgE陽性、②1,000 IU/mL以上の高IgE血症を必須項目とし、さらに③アスペルギルスに対する沈降抗体あるいは特異的IgG陽性、④ABPAに合致する画像所見、⑤末梢血好酸球増多、の③から⑤の3項目中2項目を満たす場合にABPAと診断する。本診断基準では、高IgE血症を重視していること、Ⅰ型アレルギーの根拠を皮膚反応ではなくアスペルギルス特異的IgE陽性でも可としていること、アスペルギルスに対する沈降抗体や喘息を必須項目としていないこと、CTの普及に伴い画像所見を重視していることなどの特徴がある。
ただし、これらはA. フミガータスによるABPAに特化した診断基準であるため、日本医療研究開発機構(AMED)のABPM調査研究班では、ABPMにも当てはめることが可能で、本邦での全国調査の結果を踏まえて感度・特異度もより向上した新・診断基準を準備中である。
治 療
経口副腎皮質ステロイド薬
喘鳴などの臨床症状や肺浸潤影の出現している急性悪化期には副腎皮質ステロイド薬の全身投与が良く奏功する。高用量プレドニゾロン(0.75mg/kg/日)から開始して6~12ヶ月継続するプロトコールと、中用量プレドニゾロン(0.5mg/kg/日)から開始してやや短い期間で減量・中止するプロトコールを比較したランダム化比較試験が92名の未治療ABPA患者に対して2009年から2011年に施行された34)。プライマリーエンドポイントである治療終了後の再燃率はいずれも46%で、2つのプロトコール間に有意差はなかった。治療開始6週時点での臨床症状、IgE値、画像の総合改善率は高用量ステロイド群で100%、中等量群で88%であったが、ステロイドの副作用は前者で80%、後者で29%に認められた。
胸部X線写真の改善とともに血清IgEが25%以上の低下傾向を認めた場合は治療効果ありと考えてよい。ただし、ステロイドの減量・中止後の再燃率は高率であり、しばしば経口ステロイド薬の少量継続投与を必要とする。気道の構造改変(気管支拡張など)を伴っていることもあり、長期ステロイド投与患者では非結核性抗酸菌や緑膿菌などによる慢性下気道感染症を合併しやすいことに注意が必要である。
抗真菌薬
ABPAに対する抗真菌薬について、4つのランダム化比較試験と38の観察研究をまとめた最新のシステマティックレビューでは、抗真菌薬投与により、ABPA患者の自他覚所見、増悪頻度、肺機能、炎症マーカー、画像所見の改善が認められ、ステロイド減量効果があるが、コントロール研究の少なさ、各研究デザインの不均一性、観察研究におけるバイアスのために、ABPAに対する抗真菌薬投与の推奨度は弱いと結論されている35)。最近、経口ステロイドと抗真菌薬のランダム化比較試験が実施され、経口ステロイドの方が治療効果出現は早いが、いずれの治療でも3ヶ月後には臨床症状と画像所見の改善および血清IgE値の低下が全例で認められたとの報告がある36)。本症の治療における抗真菌薬の位置づけについては、各国のガイドラインで方針が微妙に異なっている。米国感染症学会のアスペルギルス診療ガイドラインでは、当初からステロイドとアゾール系抗真菌薬を併用して治療を開始することが推奨されている37)。一方日本の深在性真菌症の診断・治療ガイドライン2014では、出来るだけ原因真菌の同定を行い、抗真菌薬投与は培養で真菌が同定された場合に行うことが望ましいとされている38)。
抗真菌薬の投与期間については明確ではない。我が国のガイドラインではイトラコナゾールであれば16週間、ボリコナゾールの投与期間は不明とされている。増悪期のみに短期間使用するという方法もあるが、実際には、慢性的な経過をとり、増悪を繰り返す症例に対して用いられるため、投与期間は長期に及んでいることも予測されるが、抗真菌薬耐性のアスペルギルス・フミガータスを誘導する可能性もあるため、注意が必要である。
抗IgE抗体
抗IgE抗体(オマリズマブ)は、重症喘息において増悪頻度の減少や自覚症状の改善などの効果が報告されている。近年ABPMに対してオマリズマブの効果を検討した報告が散見される。現在までのABPMへのオマリズマブの有用性を報告した論文の多くは症例報告やごく少数例の報告であるが、Tillie-LeblondらはABPA16名に対するオマリズマブの効果を検討し、ABPA症例の喘息の増悪回数の減少と全身性ステロイド剤投与の減少効果を報告している39)。さらに2015年にはVoskampらは少数例ながらもランダム化比較試験を報告した。この報告ではオマリズマブ 375mg投与群はplacebo群に比し、増悪頻度、FeNOの減少を認めたが、呼吸機能には差を認めなかった40)。
1. Hinson KF, Moon AJ, Plummer NS. Broncho-pulmonary aspergillosis; a review and a report of eight new cases. Thorax. 1952;7(4):317-333.
2. Agarwal R, Chakrabarti A, Shah A, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin. Exp. Allergy. 2013;43(8):850-873.
3. Asano K, Kamei K, Hebisawa A. Allergic bronchopulmonary mycosis - pathophysiology, histology, diagnosis, and treatment. Asia Pac Allergy. 2018;8(3):e24.
4. Chetty A. Pathology of allergic bronchopulmonary aspergillosis. Front. Biosci. 2003;8:e110-114.
5. Chowdhary A, Agarwal K, Kathuria S, Gaur SN, Randhawa HS, Meis JF. Allergic bronchopulmonary mycosis due to fungi other than Aspergillus: a global overview. Crit. Rev. Microbiol. 2014;40(1):30-48.
6. Saito A, Takatori M, Takatori K, Taniguchi M. [Transition of Airborne Fungi during 20-Years from 1993 to 2013 in Sagamihara]. Arerugi. 2015;64(10):1313-1322.
7. O'Driscoll BR, Powell G, Chew F, et al. Comparison of skin prick tests with specific serum immunoglobulin E in the diagnosis of fungal sensitization in patients with severe asthma. Clin. Exp. Allergy. 2009;39(11):1677-1683.
8. Araujo R, Rodrigues AG. Variability of germinative potential among pathogenic species of Aspergillus. J. Clin. Microbiol. 2004;42(9):4335-4337.
9. Imtiaj A, Jayasinghe C, Lee GW, et al. Physicochemical Requirement for the Vegetative Growth of Schizophyllum commune Collected from Different Ecological Origins. Mycobiology. 2008;36(1):34-39.
10. Oguma T, Asano K, Tomomatsu K, et al. Induction of mucin and MUC5AC expression by the protease activity of Aspergillus fumigatus in airway epithelial cells. J. Immunol. 2011;187(2):999-1005.
11. Alp S, Arikan S. Investigation of extracellular elastase, acid proteinase and phospholipase activities as putative virulence factors in clinical isolates of Aspergillus species. J. Basic Microbiol. 2008;48(5):331-337.
12. Katzenstein AL, Liebow AA, Friedman PJ. Bronchocentric granulomatosis, mucoid impaction, and hypersensitivity reactions to fungi. Am. Rev. Respir. Dis. 1975;111(4):497-537.
13. Bosken CH, Myers JL, Greenberger PA, Katzenstein AL. Pathologic features of allergic bronchopulmonary aspergillosis. Am. J. Surg. Pathol. 1988;12(3):216-222.
14. Hebisawa A, Tamura A, Kurashima A, et al. [Pathologic reconsideration on allergic bronchopulmonary aspergillosis and mycosis]. Nihon Kokyuki Gakkai Zasshi. 1998;36(4):330-337.
15. Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532-1535.
16. Gazendam RP, van Hamme JL, Tool AT, et al. Human Neutrophils Use Different Mechanisms To Kill Aspergillus fumigatus Conidia and Hyphae: Evidence from Phagocyte Defects. J. Immunol. 2016;196(3):1272-1283.
17. Ueki S, Konno Y, Takeda M, et al. Eosinophil extracellular trap cell death-derived DNA traps: Their presence in secretions and functional attributes. J. Allergy Clin. Immunol. 2016;137(1):258-267.
18. Muniz VS, Silva JC, Braga YAV, et al. Eosinophils release extracellular DNA traps in response to Aspergillus fumigatus. J. Allergy Clin. Immunol. 2017.
19. Agarwal R, Khan A, Gupta D, Aggarwal AN, Saxena AK, Chakrabarti A. An alternate method of classifying allergic bronchopulmonary aspergillosis based on high-attenuation mucus. PLoS One. 2010;5(12):e15346.
20. Behera D, Guleria R, Jindal SK, Chakrabarti A, Panigrahi D. Allergic bronchopulmonary aspergillosis: a retrospective study of 35 cases. Indian J. Chest Dis. Allied Sci. 1994;36(4):173-179.
21. Chakrabarti A, Sethi S, Raman DS, Behera D. Eight-year study of allergic bronchopulmonary aspergillosis in an Indian teaching hospital. Mycoses. 2002;45(8):295-299.
22. Ishiguro T, Takayanagi N, Kagiyama N, Shimizu Y, Yanagisawa T, Sugita Y. Clinical characteristics of biopsy-proven allergic bronchopulmonary mycosis: variety in causative fungi and laboratory findings. Intern. Med. 2014;53(13):1407-1411.
23. Kim JH, Jin HJ, Nam YH, Hwang EK, Ye YM, Park HS. Clinical features of allergic bronchopulmonary aspergillosis in Korea. Allergy Asthma Immunol. Res. 2012;4(5):305-308.
24. Oguma T, Taniguchi M, Shimoda T, et al. Allergic bronchopulmonary aspergillosis in Japan: A nationwide survey. Allergol Int. 2018;67(1):79-84.
25. Prasad R, Garg R, Sanjay, Shukla AD. Allergic bronchopulmonary aspergillosis: A review of 42 patients from a tertiary care center in India. Lung India. 2009;26(2):38-40.
26. Tanimoto H, Fukutomi Y, Yasueda H, et al. Molecular-based allergy diagnosis of allergic bronchopulmonary aspergillosis in Aspergillus fumigatus-sensitized Japanese patients. Clin. Exp. Allergy. 2015;45(12):1790-1800.
27. Ye F, Zhang NF, Zhong NS. [Clinical and pathological analysis of allergic bronchopulmonary aspergillosis in China]. Zhonghua Jie He He Hu Xi Za Zhi. 2009;32(6):434-438.
28. Zhang M, Gao J. Clinical Analysis of 77 Patients with Allergic Bronchopulmonary Aspergillosis in Peking Union Medical College Hospital. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2017;39(3):352-357.
29. Glancy JJ, Elder JL, McAleer R. Allergic bronchopulmonary fungal disease without clinical asthma. Thorax. 1981;36(5):345-349.
30. Shah A, Kunal S. A review of 42 asthmatic children with allergic bronchopulmonary aspergillosis. Asia Pac Allergy. 2017;7(3):148-155.
31. Greenberger PA, Bush RK, Demain JG, Luong A, Slavin RG, Knutsen AP. Allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2014;2(6):703-708.
32. Rosenberg M, Patterson R, Mintzer R, Cooper BJ, Roberts M, Harris KE. Clinical and immunologic criteria for the diagnosis of allergic bronchopulmonary aspergillosis. Ann. Intern. Med. 1977;86(4):405-414.
33. Greenberger PA, Patterson R. Allergic bronchopulmonary aspergillosis and the evaluation of the patient with asthma. J. Allergy Clin. Immunol. 1988;81(4):646-650.
34. Agarwal R, Aggarwal AN, Dhooria S, et al. A randomised trial of glucocorticoids in acute-stage allergic bronchopulmonary aspergillosis complicating asthma. Eur. Respir. J. 2016;47(2):490-498.
35. Moreira AS, Silva D, Ferreira AR, Delgado L. Antifungal treatment in allergic bronchopulmonary aspergillosis with and without cystic fibrosis: a systematic review. Clin. Exp. Allergy. 2014;44(10):1210-1227.
36. Agarwal R, Dhooria S, Singh Sehgal I, et al. A Randomized Trial of Itraconazole vs Prednisolone in Acute-Stage Allergic Bronchopulmonary Aspergillosis Complicating Asthma. Chest. 2018;153(3):656-664.
37. Patterson TF, Thompson GR, 3rd, Denning DW, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin. Infect. Dis. 2016;63(4):e1-e60.
38. Kohno S, Tamura K, Niki Y, et al. Executive Summary of Japanese Domestic Guidelines for Management of Deep-seated Mycosis 2014. Med. Mycol. J. 2016;57(4):E117-E163.
39. Tillie-Leblond I, Germaud P, Leroyer C, et al. Allergic bronchopulmonary aspergillosis and omalizumab. Allergy. 2011;66(9):1254-1256.
40. Voskamp AL, Gillman A, Symons K, et al. Clinical efficacy and immunologic effects of omalizumab in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2015;3(2):192-199.