サルコイドーシス
sarcoidosis
1.はじめに
140年前に、両足、指、片腕に紫色の盛り上がった皮疹を有し、併せて反復する眼のブドウ膜炎を発症した中年男性の症例がヨーロッパで報告された1)。これがサルコイドーシス(以下、サ症)の世界初の報告である。日本においては、約100年前に「類狼瘡」という名の皮膚疾患として初めて報告された2)。当初サ症は皮膚疾患として捉えられていたが、その後の知見の集積の結果、今では全身性疾患として、以下のように定義されている。「サ症は原因不明の多臓器疾患である。若年性と中年に好発する。しばしば胸部X線上で両側肺門リンパ節腫脹として現れるが、他に眼、皮膚にも病変を示すことが多い。他に肝臓、脾臓、リンパ節、唾液腺、心臓、神経、筋、骨や他の臓器に病変が見られることがある。診断は臨床的および放射線学的所見に加えて、乾酪壊死を伴わない肉芽腫(非乾酪性類上皮細胞肉芽腫)を組織学的に証明することである(図1)。その際、既知の原因(重金属など)による肉芽腫や(がんなどによる)局所的なサルコイド反応を除外しなければならない」3, 4, 5)。
サ症は原因が不明であることもあって、診断に苦慮することがある。上述のように「診断は臨床的および放射線学的所見に加えて、乾酪壊死を伴わない肉芽腫(非乾酪性類上皮細胞肉芽腫)を組織学的に証明する」という総合的な判断が必要で、この為、本邦では今までに何回か診断基準の改訂があった。また、サ症は、およそ2/3の患者が自然寛解するものの、10〜30%では慢性あるいは進行性の経過をとるため3)、どの症例に治療が必要で、どの症例が経過観察のみで良いのか、治療が必要な場合はどのタイミングで治療を開始すべきか、対応に苦慮することがある。本稿では、サ症の概要(疫学、病因、予後)を述べるとともに、最近の診断基準や治療について解説する。
2.サルコイドーシスの疫学、
病因、予後
病因、予後
サ症は世界中、あらゆる人種、ほぼすべての年齢層で男女を問わず発症するが、発症率・有病率(米国の黒人や北欧の人に多い)、重症度(米国の黒人には重症者が多いが、日本人では少ない)、罹患臓器、予後に民族差、人種差を認める3-6)。日本での最近のデータは森本らによるものである7)。発症率は人口10万人対1.01(男性 0.73、女性 1.28)で、女性の方が多く(64.4%)、発症年齢は、男性は20〜34歳にピークがある(1峰性)一方、女性は20〜34歳でのピークに加えて50〜60歳に2つ目のピークを持つ(2峰性)。罹患臓器は肺が最も多く(86%)、続いて眼(55%)、皮膚
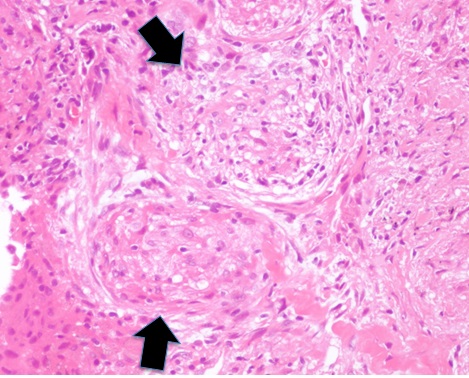
細胞成分で密になった肉芽腫を認め(矢印)、結核で認めるチーズ様の肉芽腫(乾酪性肉芽腫)とは区別される。
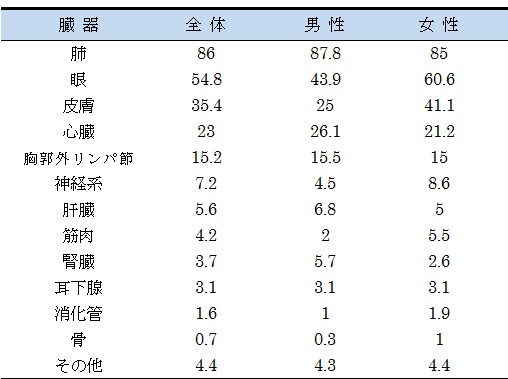
※ 一人で複数の臓器に罹患することがあるため、総数は100%を超える。
文献7)より引用、改変
(35%)、心臓(23%)の順になる(表1)。病変は1臓器にとどまることは少なく、多くは(82.1%)複数の臓器に病変を有している。胸郭内での病変では、両側肺門リンパ節腫脹(bilateral hilar lymphadenopathy: BHL)を有するものが全サ症患者の75.8%に見られる7)。これらの事実は後述する臨床診
文献12より引用
断群の診断基準にも反映されている。病変が複数の臓器に及ぶにも関わらず、患者の3割弱が無症候性で、健康診断などで発見される7)。
病因は定義に示す通り不明であるものの、環境要因と宿主(患者)の疾患感受性の双方が発症に影響を及ぼしていると考えられる6)。環境要因には、感染(ウィルス:ヘルペスウィルス、レトロウィルス、コクサッキーウィルスなど、細菌:マイコバクテリウム属、プロピオニバクテリウム属など)、無機物質(アルミニウム、亜鉛、タルクなど)、有機物質(松の花粉、粘土など)などが挙げられてきた。その中で、毛根に常在する嫌気性菌のPropionibacterium acnes(P. acnes)が有力な原因物質として報告されている8)。これまでの知見によれば、サ症の病変組織の培養から唯一P. acnesだけが培養された。また、サ症患者のリンパ節では高いゲノム量のP. acnesが認められ9)、P. acnesの特異的な抗体を用いた免疫染色で染まった8)。加えてあらかじめP. acnesで感作したウサギにP. acnesを静注すると、肺に肉芽腫が形成されることが報告されている10)。しかし、常在菌(P. acnes)がどうして疾患(サ症)の病原菌になり得るのであろうか。正常な免疫能を持つ健常者や免疫能が低下した免疫不全者ではサ症を発症しない。しかし、サ症患者はP. acnesに対して過剰な免疫能を有するため、潜在するP. acnesに対して炎症を惹起し、肉芽腫を形成すると考えられる8)。
予後は通常良好であり、およそ2/3の患者が自然寛解する。その一方で、10〜30%では慢性あるいは進行性の経過をとる3)。我々が115例の自験例を対象に行った調査でも、増悪群15%、不変群23%、改善群62%であり、日本人でも概ね海外のステートメントに記載されている値と同様であることがうかがえる11)。
3.診断基準
診断の原則は組織から非乾酪性類上皮細胞肉芽腫(図1)を証明し、かつ他の肉芽腫性疾患を除外することである。しかし、実際の臨床の場では、必ずしも組織学的な証明ができないこともあり、臨床症状と特徴的な検査所見から診断することもある(臨床診断群)。この際の診断基準は今までに数回改訂された
が、2015年1月に重症度分類と併せて新しい診断基準が確定した。サ症が全身性疾患であることを鑑み、「呼吸器病変、眼病変、心臓病変の3臓器のうちの2臓器でサ症を強く示唆する臨床所見があり、かつ特徴的な検査所見5項目中2項目が陽性の場合」に臨床診断群としている。検査所見5項目とは、①両側肺門リンパ節腫張、②血清アンジオテンシン変換酵素(ACE)活性高値または血清リゾチーム高値、③血清可溶性インターロイキン−2受容体(sIL-2R)高値、④Ga-67citrateシンチグラフィまたはF-18FDG PETにおける著明な集積所見、⑤気管支肺胞洗浄検査でリンパ球比率の上昇、CD4/CD8比が3.5を超える上昇となる。しかし、この臨床診断群の診断基準がどの程度正確な診断を反映しているかは現段階では不明である12)。
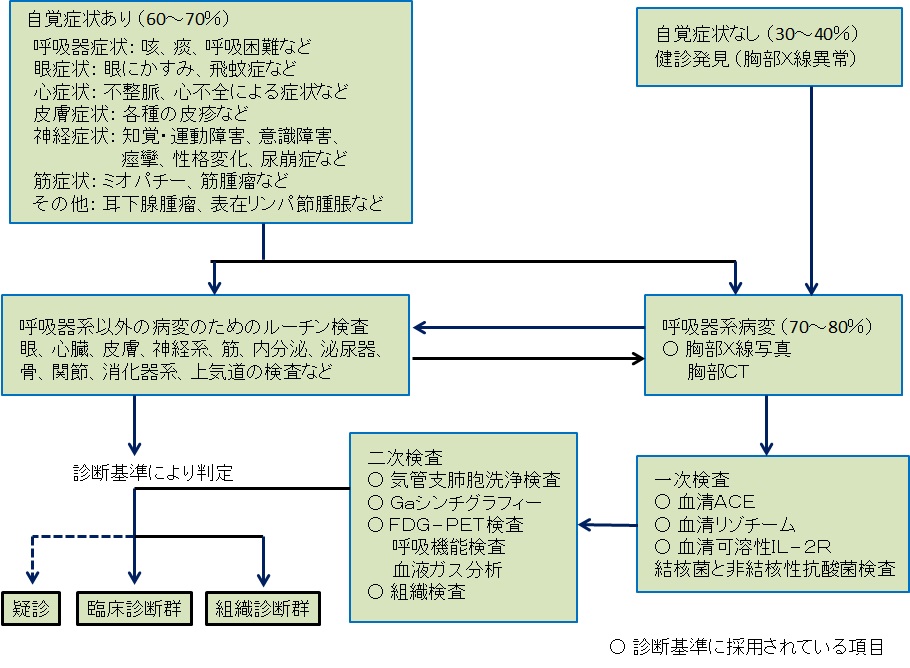
日本サルコイドーシス/肉芽腫性疾患学会では、サルコイドーシスの診断手順(図2)を提示している。患者の3割弱が無症候性であることから、自覚症状がある場合とない場合に分けて、診断を進める。できる限り、組織診断(非乾酪性類上皮細胞肉芽腫)に努め、加えて十分な除外診断が大切である。
4.治療
既述したように、サ症は、およそ2/3の患者が自然寛解する。一方、10〜30%では慢性あるいは進行性の経過をとる3)。また、罹患臓器によって症状も様々である。したがって、どの症例に治療が必要で、どの症例が経過観察で良いのか、その判断には慎重さが求められる。加えて、治療に対するエビデンスに乏しいことも、治療に対して慎重になる要因となっている。治療の対象となるのは生命の危機が危惧される場合、重大な臓器機能障害が認められる場合、そして症状のためにQOLの低下が認められる場合である13)。例えば、心臓病変(不整脈など)や神経病変(尿崩症、顔面神経麻痺など)に対しては、速やかに薬物治療の適応となることが多い。一方肺病変では、検査値の悪化(血清ACEやsIL-2Rの上昇、両側肺門リンパ節腫大の悪化、胸部X線での陰影の出現など)だけでは、治療の適応にはならない14)。肺サ症に関して言えば、症状(特に呼吸困難)の悪化、努力性肺活量(FVC)や肺拡散能(DLCO)の著しい低下、画像の著しい悪化(空洞形成、網状陰影の出現など)などが治療開始への判断材料となる15)。治療の第一選択薬は経口のグルココルチコイド(プレドニゾロンなど)である。一般的にはプレドニゾロンとして0.5mg/kg/日で開始し、2〜4週間継続した後、4〜8週間かけて5〜10mg/日ずつ減量することが多い。再燃が認められたら適宜増量する16)。プレドニゾロンは、呼吸困難の症状に加えて呼吸機能や画像上の改善効果を長期(5年)にわたって示すことが証明されている17)。しかし、グルココルチコイドは、副作用を考慮して使用しなければならない。グルココルチコイド治療を受けたサ症患者は、治療を受けなかった群に比べて有意に悪い影響(副作用)が認められた。しかもその影響はグルココルチコイドの総服用量および治療期間と関連していた18)。従って、グルココルチコイドは、極力減量して行くことが望まれる19)。しかし、減量がうまくいかない場合には、他の薬剤との併用が検討される。代表的な薬剤はメトトレキサートである。メトトレキサートを用いた二重盲検対照試験では、肺機能の悪化を認めないことに加えて、グルココルチコイドの使用量を少なく抑え、体重増加などの副作用も軽減することが示されている20)。他にアザチオプリンが使用されることもある。アザチオプリンには、メトトレキサートと同様のステロイド節約効果(ステロイドの服用を少量にとどめる効果)があることが報告されている21)。また、サ症の肉芽腫形成に必須のサイトカインであるTNF(tumor necrosis factor)αをターゲットとして、TNF阻害薬が使われることもある。今までの報告では、グルココルチコイドに抵抗性で、かつ活動性のある肺サ症に対し、抗ヒトTNFαモノクローナル抗体のインフリキシマブが有効性を示している22)。以上に挙げた治療薬は、グルココルチコイド以外には保険適応がない。加えて、各薬剤にも副作用が報告されているため、治療薬を適応するには慎重を要する。
5.おわりに
サ症の概要(疫学、病因、予後)を述べるとともに、最近の診断基準や治療について解説した。今までの治療における報告は、症例数の小さなものが多く、今後、よりサイズの大きなrandomized control testが望まれる。
1) Huthinson J:Case of livid papillary psoriasosis. Illustrations of Clinical surgery, J & A Churchill, London, 1877, 834-836.
2) 竹谷 實:類狼瘡一名類肉腫ニ就て. 皮膚科及泌尿器科雑誌 1921; 21: 943-959.
3) American Thoracic Society:Statement of sarcoidosis. Am J Respir Crit Care Med 1999; 160: 736-755.
4) 奈良正之:肺サルコイドーシスの動向 日内会誌 2016; 105: 905-910.
5) 奈良正之:サルコイドーシス 産科と婦人科 2018; 85: 683-686.
6) Valeyre D, et al. : Sarcoidosis. Lancet 2014; 383: 1155-1167.
7) Morimoto T, et al. : Epidemiology of sarcoidosis. Eur Respir J 2008; 31: 372-379.
8) Eishi Y:Etiologic link between sarcoidosis and Propionibacterium acnes. Respir Investig 2013; 51: 56-68.
9) Ishige I, et al.:Quantitative PCR of mycobacterial and propionibacterial DNA in lymph nodes of Japanese patients with sarcoidosis. Lancet 1999; 354: 120-123.
10) Ichiyasu H, et al.:Role of monocyte chemoattractant protein-1 in Propionibacterium acnes-induced pulmonary granulomatosis. Micro Res Tech 2001; 53: 188-297.
11) 村上康司 他:診断基準改訂前後のサルコイドーシスの臨床的特徴と予後予測因子としてのsIL-2R変化率の検討 日サ会誌 2013; 33: 83-89.
12) 四十坊典晴 他:わが国におけるサルコイドーシスの診断基準と重症度分類日サ会誌 2015; 35: 3-8.
13) Baughman RP, et al.:The indications for the treatment of sarcoidosis: Wells Law. Sarcoidosis Vasc Diffuse Lung Dis 2017; 34: 280-282.
14) 津田富康:サルコイドーシスの治療. サルコイドーシスとその他の肉芽腫性疾患. 日本サルコイドーシス/肉芽腫性疾患学会編. 初版. 克誠堂出版. 東京. 2006. 190-201.
15) Spagnolo P, et al.: Pulmonary sarcoidosis. Lancet Respir Med 2018; 6: 389-402.
16) 日本サルコイドーシス/肉芽腫性疾患学会: 治療総論. http://www.jssog.com/www/top/3.pdf
17) Gibson GJ, et al.:British thoracic society sarcoidosis study: effects of long term corticosteroid treatment. Thorax 1996; 51: 238-247.
18) Khan NA, et al.:Toxicity risk from glucocorticoids in sarcoidosis patients. Respir Med 2017; 132: 9-14.
19) Baughman RP:Steroids for sarcoidosis: how much and for how long? Respir Med 2018; 138: S5-S6.
20) Baughman RP, et al.:Methotrexate is steroid sparing in acute sarcoidosis: results of a double blind, randomized trial. Sarcoidosis Vasc Diffuse Lung Dis 2000; 17: 60-66.
21) Vorselaars AD, et al.: Methotrexate vs. azathioprine in second-line therapy of sarcoidosis. Chest 2013; 144: 805-812.
22) Rossman MD, et al.: A double-blinded, randomaized, placebo-controlled trial of infliximab in subjects with active pulmonary sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2006; 23: 201-208.
| 奈良 正之 | 東北大学病院臨床研究推進センター |
| Masayuki Nara | Clinical Research, Innovation and Education Center, Tohoku University Hospital |